ABSTRAK
Lembaran sel yang berdiri sendiri merupakan biomaterial berharga untuk digunakan dalam pengobatan regeneratif dan rekayasa jaringan. Karena lembaran sel mengalami berbagai rangsangan mekanis selama penanganan, penting untuk memahami respons sel terhadap rangsangan ini. Di sini, kami menunjukkan perubahan dalam lokalisasi berbagai protein selama peregangan lembaran sel fibroblas. Protein ini diketahui terlibat dalam mekano-sensing. Setelah peregangan, filamen aktin tampak sejajar dengan arah peregangan. Pada sambungan sel-ke-sel, β-catenin membentuk gugus yang terlokalisasi bersama dengan vinculin dan zyxin yang terakumulasi serta filamen aktin. Substrat terkait p130 Crk, yang diketahui ada dalam adhesi fokal, juga direkrut ke gugus ini dan difosforilasi. Hasil kami menunjukkan bahwa mesin mekano-sensing terbentuk pada sambungan sel-ke-sel saat lembaran sel diregangkan.
Singkatan
AJ
persimpangan adheren
ECM
matriks ekstraseluler
Bahasa Inggris
adhesi fokal
Palsu
kinase adhesi fokal
hal.130Cas
Substrat terkait p130 Crk
PNIPA
poli-N-isopropilakrilamida
1 Pendahuluan
Pembuatan cangkok jaringan untuk pengobatan regeneratif umumnya bergantung pada perancah tiga dimensi (3D) berpori yang terbuat dari bahan biokompatibel, misalnya, matriks ekstraseluler (ECM), polimer sintetis, hidrogel atau jaringan terdeselularisasi (Baharvand et al. 2006 ; Gunatillake 2003 ; Ott et al. 2008 ; Tibbitt dan Anseth 2009 ). Namun, perancah 3D ini sering mengalami masalah, seperti kepadatan sel yang tidak mencukupi dan respons imun terhadap bahan perancah setelah implantasi. Berbagai teknologi rekayasa jaringan bebas perancah telah dikembangkan untuk mengatasi masalah ini, termasuk penggunaan gaya sentrifugal atau magnetik, atau printer 3D (Ito et al. 2004 ; Matai et al. 2020 ; Mironov et al. 2008 ). Di antara ini, rekayasa jaringan lembaran sel muncul sebagai teknologi yang menjanjikan. Lembaran sel yang berdiri sendiri dibuat menggunakan polimer yang peka terhadap suhu, poli-N-isopropilakrilamida (PNIPAAm). Cawan kultur cangkok PNIPAAm kini menjadi populer di bidang pengobatan regeneratif (Okano et al. 1993 ; Yang et al. 2007 ). Dalam teknik ini, pencernaan enzimatik tidak diperlukan; sebagai gantinya, sel-sel dilepaskan dari substrat dengan menurunkan suhu di bawah nilai kritis di mana transisi fase terjadi dalam PNIPAAm. Oleh karena itu, lembaran sel dapat diperoleh saat interaksi sel-ke-sel tetap utuh. Namun, penanganan lembaran sel sulit karena kurangnya perancah, dan peregangan lembaran sel dapat terjadi selama pembuatan atau transplantasi jaringan, yang dapat menyebabkan respons mekanis yang tidak diinginkan pada sel.
Penginderaan rangsangan mekanis merupakan reaksi utama dalam berbagai proses biologis, termasuk migrasi sel, diferensiasi sel, dan metastasis kanker. Fluks ion melalui saluran yang peka terhadap mekano (Guharay dan Sachs 1984 ; Sokabe et al. 1991 ), pensinyalan dari perlekatan sel-matriks (Abercrombie dan Dunn 1975 ; Morgan et al. 2007 ), dan pensinyalan dari sambungan sel-sel (Takeichi 1995 ; Yamada et al. 2005 ) merupakan mekanisme penginderaan-mekano utama. Pada sel mamalia, studi tentang penginderaan-mekano sebagian besar berfokus pada pensinyalan melalui adhesi fokal (FA), yang terdiri dari komponen protein, terutama integrin, talin, vinculin, substrat terkait p130 Crk (p130Cas), kinase FA (FAK), dan paxillin pada antarmuka sel-substrat (Moore et al. 2010 ). FA melekat pada serat stres, yang tersusun atas filamen aktin, sehingga mampu menyalurkan gaya yang dihasilkan terutama melalui motor miosin II pada serat stres ini ke substrat di bawahnya.
Kadherin adalah protein adhesi antarsel yang terdapat pada persambungan adheren (AJ) antarsel. Gaya mekanis yang diberikan pada AJ dirasakan oleh kompleks kadherin–katenin (Borghi et al. 2012 ; Ladoux et al. 2010 ; Matsuda et al. 2005 ) dan kemudian ditransduksi ke dalam kaskade pensinyalan intrasel (Tzima et al. 2005 ). Pada sel epitel, beberapa protein adaptor seperti α-katenin dan vinculin bekerja dengan kadherin (Ladoux et al. 2010 ; le Duc et al. 2010 ; Yonemura et al. 2010 ) atau melalui aktivasi saluran Ca 2+ yang peka terhadap peregangan (Ko et al. 2001 ) untuk memastikan remodeling sitoskeleton aktin. Namun, masih ada kontroversi mengenai apakah kadherin berfungsi sebagai mekanosensor pada fibroblas. Salah satu peran utama fibroblas in vivo adalah dalam produksi ECM. Stimulasi mekanis fibroblas menghasilkan remodeling filamen aktin, perubahan ekspresi gen, dan peningkatan produksi ECM (Chiquet et al. 2009 ). Peningkatan produksi ECM meningkatkan kekakuan matriks, yang selanjutnya mengubah ekspresi gen dalam sel-sel di sekitarnya (Alcaraz et al. 2008 ; Rizki et al. 2008 ). Proses ini dapat mengatur nasib sel, misalnya melalui pengaruh diferensiasi sel dan tumorigenesis (Butcher et al. 2009 ).
Dalam studi ini, respons sel terhadap peregangan mekanis pada lembaran sel berlapis tunggal yang dibuat dari fibroblas NIH 3T3 diselidiki. Kami memilih lini sel fibroblas karena fibroblas telah dimasukkan dalam berbagai jaringan rekayasa hayati seperti lapisan dermal cangkok kulit dan lembaran sel jantung yang dikultur bersama dengan fibroblas jantung (Iwamiya et al. 2016 ; Vig et al. 2017 ) dan peregangan fibroblas dalam jaringan ini dapat mengubah sifat cangkokan. Kedua ujung lembaran sel ditempelkan pada sepasang jarum mikro-kaca dan diregangkan di bawah mikroskop fluoresensi. Kami menemukan bahwa peregangan menginduksi pembentukan serat aktin, yang diikuti oleh relokasi α-catenin, β-catenin, p130Cas dan zyxin. Hasil ini menunjukkan bahwa lembaran sel dengan cepat merasakan peregangan mekanis, yang dapat mengubah keadaan sel saat lembaran sel diregangkan selama penanganan untuk fabrikasi atau implantasi jaringan.
2 Hasil
2.1 Peregangan Mekanis Lembaran Sel
Kami menyiapkan lembaran sel dari fibroblas NIH3T3, yang mengekspresikan N-kadherin alih-alih E-kadherin (Reynolds et al. 1996 ). Gangguan lembaran sel tanpa adanya Ca 2+ (Informasi Pendukung: Gambar S1A ) dan analisis imunofluoresensi (Informasi Pendukung: Gambar S1B ) menunjukkan keterlibatan N-kadherin dalam interaksi sel-ke-sel di dalam lembaran sel. Serat stres yang diamati pada permukaan yang dicangkok PNIPAAm (Informasi Pendukung: Gambar S2A ) menghilang ketika sel dilepaskan dari permukaan dengan menurunkan suhu (Informasi Pendukung: Gambar S2B ) dan tidak terbentuk kembali bahkan ketika suhu dikembalikan ke 37°C (Informasi Pendukung: Gambar S2C ). Sebaliknya, filamen aktin terlokalisasi di daerah batas sel-ke-sel di dalam lembaran sel. Filamen aktin diamati di seluruh sitoplasma setelah menempel kembali pada permukaan yang kaku (Informasi Pendukung: Gambar S2D ). Pengamatan ini dengan jelas menunjukkan bahwa organisasi filamen aktin sebagian besar dipengaruhi oleh perlekatan sel pada substrat.
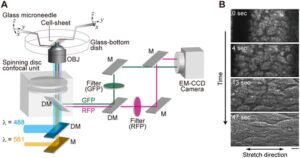
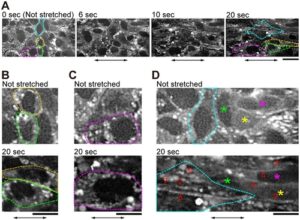
Untuk menerapkan gaya eksternal pada lembar sel mengambang, kami membuat sistem mikroskop yang terdiri dari dua set mikromanipulator dan unit confocal waktu nyata yang dihubungkan secara serial ke sistem tampilan ganda (Gambar 1A , Bagian 4 ). Lembar sel yang melekat pada jarum mikro dapat diregangkan dengan menggerakkan salah satu jarum mikro secara linier menjauh dari yang lain (Gambar 1B ). Sel dan inti sel berubah bentuk ke arah peregangan dan tetap berubah bentuk sampai pengamatan selesai (Gambar 2A,B , Informasi Pendukung: Film S1 ). Sel mempertahankan posisi relatifnya dalam lembar sel bahkan setelah peregangan (Gambar 2A ), yang menunjukkan bahwa interaksi sel-sel dipertahankan selama prosedur peregangan.
2.2 Remodeling Filamen Aktin melalui Peregangan Mekanis
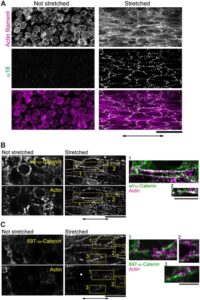
Sementara ketegangan pada E-kadherin memerlukan kontraksi aktomiosin (Borghi et al. 2012 ; Harris et al. 2012 ), masih belum diketahui bagaimana gaya yang diterapkan secara eksternal pada sambungan sel-ke-sel mempengaruhi perombakan aktin sitoskeleton. Setelah peregangan, struktur aktin seperti titik meningkat di sebagian besar sel, baik pada sel yang sebelumnya tidak memiliki struktur (Gambar 2A , Tidak diregangkan) dan pada sel yang mengandung struktur sebelum peregangan (Gambar 2C ). Filamen aktin terlihat jelas sepanjang sumbu peregangan (Gambar 2D , Informasi Pendukung: Film S1 , lih. Gambar 3A ). Kami mengonfirmasi bahwa filamen aktin yang baru muncul bukanlah filamen yang bergerak dari bidang yang tidak fokus dengan mengumpulkan gambar tumpukan-z dari lembaran sel sebelum peregangan (Informasi Pendukung: Film S2 dan S3 ).
2.3 Akumulasi Protein AJ di Persambungan Sel-Sel melalui Peregangan Mekanis
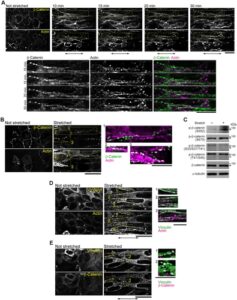
Berikutnya, kami menyelidiki bagaimana ketegangan ditransmisikan ke dalam sel melalui sambungan sel-sel di lembar sel. Dalam AJ, vinculin mengikat filamen aktin dan α-catenin (Huveneers dan de Rooij 2013 ). Situs pengikatan vinculin dalam α-catenin dianggap terbuka saat diregangkan (Yonemura et al. 2010 ). Konsisten dengan laporan ini, antibodi α18, yang mengenali α-catenin di bawah ketegangan (Nagafuchi dan Tsukita 1994 ), terikat pada situs sambungan sel-sel di lembar sel saat diregangkan (Gambar 3A ). Lebih jauh, pengenalan mutan delesi α-catenin yang tidak memiliki situs pengikatan vinculin (697-α-catenin) ke dalam sel mengganggu pembentukan filamen aktin saat diregangkan (Gambar 3B,C , Informasi Pendukung: Film S4 dan S5 ). Ketegangan juga mengubah distribusi protein yang berasosiasi dengan AJ, seperti β-catenin dan vinculin. Beta-catenin, yang didistribusikan secara homogen pada sambungan sel-ke-sel dalam kondisi tidak teregang, membentuk gugusan segera setelah peregangan diterapkan (Gambar 4A ). Di area tempat gugusan β-catenin muncul, akumulasi filamen aktin (Gambar 4A,B , Informasi Pendukung: Film S6 ) dan vinculin diamati (Gambar 4D,E , Informasi Pendukung: Film S7 dan S8 ). Gugusan ini menyerupai yang diamati sebelumnya pada fibroblas dan sel epitel, yang tersusun atas P-kadherin, α/β-catenin, ZO-1, dan aktin (Adams et al. 1996 ; Vasioukhin et al. 2000 ; Yonemura et al. 1995 ). Karena AJ punctate terbentuk dalam sel pada permukaan yang kaku (Informasi Pendukung: Gambar S3 ), gugusan α/β-catenin dan vinculin yang terbentuk dalam lembaran sel yang teregang sering muncul secara periodik.
Selain itu, peregangan memengaruhi status fosforilasi β-katenin. Interaksi N-kaderin dan E-kaderin memediasi transduksi stres mekanis ke dalam jalur pensinyalan seluler (Ganz et al. 2006 ). Beta-kaderin, yang secara langsung mengikat domain intraseluler kadherin dan protein pengikat aktin α-katenin, merupakan mediator mekanotransduksi pada adhesi berbasis kadherin (Desprat et al. 2008 ; Morales-Camilo et al. 2024 ; Röper et al. 2018 ). Diketahui bahwa fosforilasi β-catenin pada Ser 552 (Fang et al. 2007 ) atau Ser 675 (Hino et al. 2005 ; Taurin et al. 2006 ) meningkatkan aktivitas pensinyalannya dan menyebabkan lokalisasi β-catenin ke kontak sel-ke-sel (Maher et al. 2010 ), sedangkan β-catenin yang terfosforilasi pada S33/S37/T41 atau T41/S45 tidak dapat berasosiasi dengan kadherin (Maher et al. 2010 ). Dalam lembaran sel fibroblas, terdapat peningkatan signifikan dalam fosforilasi pada S552 β-catenin setelah 1 menit peregangan (Gambar 4C ), yang dikonfirmasi oleh analisis densitometri (Informasi Pendukung: Gambar S4A ). Sebagai respons terhadap peregangan, sedikit peningkatan fosforilasi pada S675 β-catenin diamati, sementara fosforilasi pada S33/S37/T41 dan T41/S45 tidak terpengaruh (Gambar 4C ).
Hasil kami menunjukkan bahwa tekanan mekanis pada lapisan sel meregangkan α-catenin, mengekspos tempat pengikatan vinculin, dan meningkatkan perlekatan filamen aktin ke kompleks sambungan sel-ke-sel. Ketegangan eksternal juga merangsang fosforilasi β-catenin pada S552 dan S675, yang menghasilkan transduksi sinyal dari sambungan sel-ke-sel ke jalur intraseluler.
2.4 Akumulasi Protein FA di Persambungan Sel-Sel melalui Peregangan Mekanis
Protein FA seperti FAK dan paxillin direkrut ke persimpangan sel-sel setelah stimulasi mekanis, dan p130Cas terlokalisasi bersama dengan nefrocystin di persimpangan sel-sel dalam sel epitel (Birukova et al. 2007 ; Donaldson et al. 2000 ; Sun et al. 2009 ). Mengingat bahwa pembentukan filamen aktin dan remodeling protein AJ diinduksi setelah peregangan mekanis, protein FA dalam lembaran sel fibroblas juga dapat direkrut ke persimpangan sel-sel tanpa adanya FA dan berinteraksi dengan protein AJ sebagai respons terhadap peregangan. Sejalan dengan hipotesis ini, p130Cas membentuk gugus di persimpangan sel-sel sepanjang filamen aktin dan terlokalisasi bersama dengan gugus β-catenin (Gambar 5A,B , Informasi Pendukung: Film S9 dan S10 ). Lokalisasi tersebut kontras dengan p130Cas di FA pada permukaan kaku (Informasi Pendukung: Gambar S3D,E ). Lebih jauh, fosforilasi p130Cas meningkat dalam 1 menit peregangan (Gambar 5C ), yang dikonfirmasi oleh analisis densitometri (Informasi Pendukung: Gambar S4B ). Protein FA lain, FAK, juga menunjukkan peningkatan fosforilasi sebagai respons terhadap peregangan (Gambar 5C ). Hasil ini menunjukkan bahwa protein FA termasuk p130Cas dan FAK direkrut ke lokasi sambungan sel-ke-sel yang menahan gaya dan mengaktifkan jalur pensinyalan hilir.
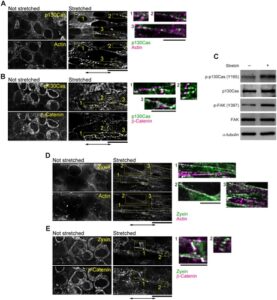
Peregangan juga memengaruhi lokalisasi zyxin. Zyxin adalah protein yang terdapat di FA (Informasi Pendukung: Gambar S3F ) dan AJ (Informasi Pendukung: Gambar S3G ). Lokalisasi zyxin ke FA bergantung pada gaya mekanis pada fibroblas dan sel epitel (Colombelli et al. 2009 ; Hirata et al. 2008 ; Nguyen et al. 2010 ), dan keberadaannya di tempat adhesi kadherin dengan aktin, α/β-catenin, dan vinculin juga telah diamati di sel epitel (Hansen dan Beckerle 2006 ; Nguyen et al. 2010 ; Vasioukhin et al. 2000 ). Di sini, ketika lembaran sel fibroblas diregangkan, lokalisasi zyxin berubah dari distribusi luas dalam sitosol menjadi struktur berkelompok (Gambar 5D , Informasi Pendukung: Film S11 ). Di wilayah yang sama, filamen aktin memanjang ke arah peregangan dan gugus β-catenin juga hadir (Gambar 5E , Informasi Pendukung: Film S12 ). Zyxin diketahui mendorong perakitan aktin yang dimediasi E-kadherin di AJ (Nguyen et al. 2010 ), yang menunjukkan bahwa perekrutan zyxin melalui gaya yang diterapkan secara eksternal mendorong polimerisasi aktin di persimpangan sel-ke-sel yang dimediasi N-kadherin di lembaran sel fibroblas.
3 Diskusi
Kontraktilitas aktomiosin diperlukan untuk transduksi mekano melalui kompleks E-kadherin/katenin dalam lembaran sel epitel (Harris et al. 2012 ). Karena serat stres lebih banyak terdapat pada fibroblas daripada pada sel epitel pada permukaan yang kaku, pembentukan dan perombakan kerangka sel aktin yang bergantung pada gaya mungkin lebih sensitif pada fibroblas. Di sini, sejauh pengetahuan kami, efek peregangan mekanis pada lembaran sel fibroblas yang tersuspensi dilaporkan untuk pertama kalinya. Kami menunjukkan bahwa serat stres menghilang ketika lembaran sel fibroblas terlepas dari substrat (Gambar 2 , Informasi Pendukung: Film S2 ). Reseptor adhesi integrin merekrut protein FA, termasuk p130Cas dan FAK, setelah mengikat matriks ekstraseluler. Proses ini selanjutnya mengaktifkan Rho GTPase, yang menginduksi polimerisasi aktin dan kontraksi aktomiosin, dan sitoskeleton aktin juga mengatur aktivasi integrin (Pelham dan Wang 1997 ; Shemesh et al. 2005 ; Wehrle-Haller 2002 ). Oleh karena itu, hilangnya asam lemak setelah terlepas dari substrat sangat mungkin mengganggu pembentukan serat stres, seperti yang kami amati di sini.
Ketika sel diregangkan dan dipertahankan, filamen aktin diamati (Gambar 2-5 ) . Struktur aktin ini menyerupai yang ditemukan dalam sel endotel di jaringan yang terpapar gaya mekanik tinggi (White et al. 1983 ; Wong et al. 1983 ). Struktur seperti titik dan filamen muncul bahkan selama peregangan (Gambar 2A , Informasi Pendukung: Film S1 ). Oleh karena itu, kemungkinan besar struktur ini awalnya dibentuk oleh penataan ulang filamen aktin yang ada (Hirata et al. 2007 ) dan kemudian oleh polimerisasi monomer aktin.
Kami mengamati bahwa gugus β-catenin (Gambar 4A,B,E , Informasi Pendukung: Film S6 ) dan vinculin (Gambar 4D,E , Informasi Pendukung: Film S7 ) muncul setelah peregangan, dan bahwa setiap gugus β-catenin dan vinculin terlokalisasi bersama filamen aktin (Gambar 3B,D , Informasi Pendukung: Film S6 dan S7 ) dan satu sama lain (Gambar 4E , Informasi Pendukung: Film S8 ). Oleh karena itu, ketiga protein ini kemungkinan terlokalisasi bersama ketika gaya mekanis hadir. Beta-catenin dan vinculin keduanya merupakan komponen AJ. AJ dibentuk oleh kadherin yang terhubung ke jaringan filamen aktin sitosolik (Abe dan Takeichi 2008 ; Harris dan Tepass 2010 ; Taguchi et al. 2011 ). Laporan sebelumnya telah menunjukkan bahwa vinculin merasakan rangsangan mekanis dan direkrut ke struktur positif kadherin di persimpangan sel-sel di bawah tekanan (Huveneers dan de Rooij 2013 ; Twiss et al. 2012 ; Yonemura et al. 2010 ). Mempertimbangkan ko-lokalisasi protein yang diketahui saling mengikat, kemungkinan besar protein ini membentuk kompleks yang menyerupai AJ di lembaran sel fibroblas saat diregangkan.
Domain substrat p130Cas, yang dicirikan oleh 15 motif YXXP, difosforilasi oleh Src di situs FA (Moore et al. 2010 ). Gaya mekanis memaparkan motif YXXP dari p130Cas dan meningkatkan kerentanannya terhadap fosforilasi (Sawada et al. 2006 ). Di sini, kami menemukan bahwa dalam lembaran sel fibroblas p130Cas tidak terlokalisasi ke area spesifik apa pun dalam kondisi tanpa gaya (Gambar 5A,B ). Namun, setelah diregangkan, p130Cas terkolokalisasi dengan aktin dan β-catenin (Gambar 5A,B , Informasi Pendukung: Film S9 dan S10 ). Secara keseluruhan, masuk akal bahwa tingkat fosforilasi p130Cas meningkat (Gambar 5C ), yang kemudian diikuti dengan perakitan aktin yang diinduksi di situs sambungan sel-ke-sel yang menahan gaya.
Dalam studi ini, kami menunjukkan bahwa struktur berkelompok yang terdiri dari β-catenin, vinculin, zyxin, p130Cas, dan filamen aktin muncul di persimpangan sel-ke-sel setelah penerapan peregangan. Struktur serupa yang terdiri dari filamen kadherin, α-catenin, vinculin dan aktin telah diamati di tempat adhesi sel-ke-sel dalam sel epitel dan endotel (Huveneers et al. 2012 ; Millán et al. 2010 ; Yonemura et al. 1995 ). Struktur punctate yang terdiri dari filamen E-kadherin dan aktin juga telah dilaporkan dalam sel epitel (Adams et al. 1998 ). Meskipun kami tidak mencitrakan kadherin dalam studi kami dan studi sebelumnya tidak mengidentifikasi p130Cas di tempat-tempat ini, kesamaan dalam penampilan dan komposisi protein menunjukkan bahwa struktur ini setara. Khususnya, penelitian sebelumnya telah menunjukkan bahwa komponen FA dan AJ termasuk zyxin, β-catenin, talin, paxillin dan kadherin direkrut ke filamen aktin yang sangat tegang baik secara in vitro maupun pada fibroblas hidup (Kiyoshima et al. 2019 ; Smith et al. 2010 ; Sun et al. 2020 ). Dengan demikian, ada kemungkinan bahwa struktur rumit yang terdiri dari kadherin, α/β-catenin, vinculin, zyxin, p130Cas dan filamen aktin terbentuk pada sambungan sel-ke-sel di lembaran sel fibroblas dengan adanya gaya eksternal.
Respons terhadap rangsangan mekanis sering dipelajari dalam sel yang dikultur pada membran elastis, atau dengan menerapkan tegangan geser menggunakan aliran laminar. Telah dilaporkan bahwa produksi kolagen diatur ke atas oleh peregangan siklik pada fibroblas (Kim et al. 2002 ; Yang et al. 2004 ), yang menunjukkan bahwa, ketika cangkok jaringan diregangkan selama prosedur implan, kekakuan jaringan dapat dipengaruhi oleh peningkatan regulasi ECM yang berpotensi memengaruhi hasil implantasi. Metode kami dapat berfungsi sebagai model pseudo-jaringan 2D untuk mempelajari efek rangsangan mekano selama penanganan cangkok jaringan yang dibuat, sehingga memberikan wawasan tentang perubahan keadaan sel selama prosedur pembuatan jaringan atau implantasi.
4 Bahan dan Metode
4.1 Kultur Sel
Sel NIH 3T3 dibeli dari Riken Cell Bank (Riken, Tsukuba, Ibaraki, Jepang) dan dikultur dalam DMEM (11965, Thermo Fisher Scientific, Waltham, MA, AS) yang dilengkapi dengan 10% serum fetal bovin (FBS; 10279, Thermo Fisher Scientific), penisilin-streptomisin (100 unit mL −1 , 15140, Thermo Fisher Scientific) pada suhu 37°C dengan 5% CO 2 . Sel secara rutin diperiksa untuk mengetahui adanya kontaminasi mikoplasma menggunakan kit deteksi MycoAlert (Lonza, Walkersville, MD, AS). Untuk persiapan sel NIH3T3 yang mengekspresikan protein fluoresen, vektor retrovirus disiapkan sebagai berikut. Dengan menggunakan pustaka cDNA limpa tikus (9536, TaKaRa, Kusatsu, Shiga, Jepang), cDNA β-catenin, vinculin, aktin, α-catenin, dan α-catenin yang tidak memiliki situs pengikatan vinculin (α-catenin697) diperkuat dengan PCR dan dikloning ke dalam vektor pcDNA3 (V79020, Thermo Fisher Scientific) dengan cDNA GFP atau RFP, kemudian dikloning ke dalam vektor retrovirus pBabe. GFP-p130Cas pBabe merupakan hadiah dari Dr. Yasuhiro Sawada. Konstruksi kloning ditransfeksi bersama dengan plasmid pengemasan ke sel HEK293T oleh FuGene6 sesuai dengan petunjuk pabrik. Supernatan retrovirus dipanen 2 hari setelah transfeksi dan diaplikasikan ke sel NIH3T3. Sel yang terinfeksi dipilih menggunakan puromisin (100 ng mL −1 , P-1033, AG Scientific, San Diego, CA, AS) dan higromisin B (200 μg mL −1 , 10687, Thermo Fisher Scientific) selama 2–3 hari.
4.2 Persiapan Lembar Sel
Sel-sel disemai ke dalam cawan UpCell 2 hari sebelum melakukan percobaan peregangan untuk memungkinkan sel-sel tersebut mencapai konfluensi 100%. Untuk pengamatan di bawah mikroskop optik, sel-sel disemai ke dalam cawan berukuran 35 mm (CS3007, CellSeed, Tokyo, Jepang). Untuk analisis imunoblot, sel-sel disemai ke dalam cawan berukuran 60 mm (CS3006, CellSeed). Lembaran sel disiapkan dengan terlebih dahulu membuang media kultur sel, kemudian mencucinya dengan 1×PBS, pH 7,4, dan akhirnya menambahkan 3 mL media Leibovitz’s CO 2 -independent (21083, Thermo Fisher Scientific) tanpa fenol merah yang ditambah dengan 10% FBS. Seluruh proses dilakukan pada pelat panas (KM-1, Kitazato Corporation, Shizuoka, Jepang) yang diatur pada suhu 40°C. Suhu kemudian diturunkan menjadi 28°C untuk memungkinkan pelepasan lembaran sel dari cawan UpCell. Pelepasan penuh lembaran sel dari cawan UpCell memerlukan waktu sekitar 20–30 menit pada suhu 28°C.
4.3 Persiapan Jarum
Batang kaca (G-1000, Narishige, Tokyo, Jepang) digunakan untuk menyiapkan jarum guna meregangkan lembaran sel. Panas diaplikasikan ke bagian tengah batang kaca sebelum dengan cepat menarik batang yang dipanaskan itu dengan cepat di kedua ujungnya untuk memperoleh diameter yang diinginkan di bagian tengahnya. Batang kaca yang ditarik dibiarkan dingin, dipotong menjadi dua dan dipangkas sesuai panjang yang diinginkan. Setiap jarum disiapkan dengan memanaskan dan membengkokkan batang kaca di dua titik (seperti yang diilustrasikan dalam Gambar 1A ), menghasilkan sudut 120° di Titik 1 dan sudut sedikit kurang dari 90° di Titik 2. Jarum dilapisi menggunakan Cell-Tak Cell and Tissue Adhesive (354241, BD Biosciences, Franklin Lakes, NJ, USA), protein pendukung adhesi sel yang dimurnikan dari Mytilusedulis . Larutan Cell-Tak disiapkan menggunakan Natrium Bikarbonat 0,1 M (37116-00, Kanto Chemical, Tokyo, Jepang), pH 8,0, dan Natrium Hidroksida 1 N (S2770, Sigma-Aldrich, St. Louis, MO, AS), menggunakan rasio yang disarankan yaitu 10 μL Cell-Tak, 285 μL natrium bikarbonat, dan 5 μL NaOH 1 N (ditambahkan segera sebelum pelapisan) untuk membuat 300 μL larutan Cell-Tak. Tiga mL larutan Cell-Tak disiapkan untuk 10–12 jarum. Jarum diinkubasi dalam larutan Cell-Tak selama 30 menit pada suhu ruangan. Jarum kemudian dicuci dengan air suling untuk menghilangkan natrium bikarbonat, dikeringkan dengan udara, dan disimpan pada suhu 4°C.
4.4 Pengaturan Optik Mikroskopi Konfokal Real-Time Dua Warna
Susunan optik (Gambar 1A ) dibangun di sekitar mikroskop terbalik (IX81, Olympus, Tokyo, Jepang). Untuk tujuan pencitraan simultan dari dua protein fluoresen, laser 488 nm (CUBE 488, Coherent, Santa Clara, CA, AS) dan laser 561 nm (Sapphire 561, Coherent) diarahkan ke unit confocal cakram berputar (CSU-10, Yokogawa, Tokyo, Jepang) yang dipasang pada port sisi kiri mikroskop. Sel diamati menggunakan objektif imersi minyak (APON 60XOTIRF, Olympus). Citra fluoresensi GFP dan RFP atau mCherry dipisahkan menggunakan cermin dichroic (FF580-FDi01, Semrock, Rochester, NY, AS) yang ditempatkan setelah unit confocal, melewati filter band pass masing-masing, FF01-520/35 (Semrock) untuk GFP dan FF01-607/36 (Semrock) untuk RFP atau mCherry, dan diproyeksikan ke kamera EM-CCD tunggal (iXonEM+ DU-897, Andor Technology, Antrium, Inggris). Irisan optik diambil sepanjang sumbu z setiap 0,198 μm menggunakan perangkat lunak Andor iQ (Andor Technology). Dekonvolusi mikrograf fluoresensi confocal pada Gambar 2 – 5 dan Informasi Pendukung: Film S1 – S12 diproses oleh perangkat lunak AutoQuant (Roper Industries, Sarasota, FL, AS).
4.5 Peregangan Lembaran Sel di Bawah Mikroskop Optik
Lembaran sel yang terpisah dipindahkan ke cawan kaca 60 mm untuk pencitraan sel hidup di bawah mikroskop optik. Lembaran sel dikultur dalam media Leibovitz’s CO 2 -independent (21083, Thermo Fisher Scientific) tanpa fenol merah, ditambah dengan 10% FBS, selama pencitraan sel hidup. Jarum (ϕ = 100–140 μm) diposisikan menggunakan mikromanipulator bermotor (EMM-3NV, Narishige). Kedua jarum disesuaikan sejajar satu sama lain dan jarak di antara keduanya ditetapkan pada 300–400 μm. Jarum diturunkan hingga ujungnya menempel pada lembar sel. Setelah 5–10 menit, lembar sel yang terikat pada jarum diangkat sehingga sel tidak lagi bersentuhan dengan dasar cawan. Suhu cawan kultur disesuaikan menggunakan inkubator panggung atas dan pemanas untuk lensa objektif (INUB-ONICS, Tokai Hit, Shizuoka, Jepang). Peregangan lembar sel dilakukan setelah pemindaian z awal dan peregangan dilakukan dalam waktu 1 menit. Pada sebagian besar percobaan kami, lembar sel diregangkan hingga 200% dari sebelum peregangan. Untuk mengurangi efek dari penempelan jarum sel, pengamatan dilakukan pada jarak yang cukup jauh dari jarum mikro (lebih dari 100 μm).
4.6 Analisis Imunoblot
Jarum (ϕ = 0,5–1 mm) diposisikan pada kedua ujung lembaran sel. Lembaran sel kemudian diregangkan dan ditahan selama 1 menit. Lembaran sel yang diregangkan, masih menempel pada kedua jarum, kemudian dicuci dengan 1× PBS dingin diikuti dengan penambahan 500 μl buffer lisis [50 mM Tris, pH 8,0, 150 mM NaCl, 1% Triton-X100, 0,5% SDS, 10 mM EDTA, 1 mM Na3VO4, 10 mM NaF, koktail penghambat protease ( 04693159001, Roche, Basel, Swiss) dan 1 mM DTT]. Jarum dilepas dan lisat dikumpulkan, disonikasi dan disentrifugasi pada 20.000 g selama 20 menit. Supernatan kemudian dikenakan SDS–PAGE. Protein dipindahkan ke membran PVDF dan diuji dengan antibodi yang ditunjukkan pada pengenceran 1:1000. Bahasa Indonesia: Antibodi anti-fosfo-β-katenin S552 (#9566), anti-fosfo-β-katenin S675 (#4176), anti-fosfo-β-katenin S33/S37/T41 (#9561), anti-fosfo-β-katenin T41/S45 (#9565), anti-β-katenin (#9562), anti-fosfo-p130Cas Y165 (#4015), anti-FAK (#3285) (Cell Signaling Technology, Danvers, MA, AS), anti-p130Cas (klon 2C1.1; Merck, Darmstadt, Jerman), anti-fosfo-FAK Y397 (#07-829) (Merck), dan anti-α-tubulin (klon B-5-1-2; Sigma-Aldrich) digunakan untuk imunoblotting. Intensitas pita diukur dengan densitometri menggunakan perangkat lunak ImageJ (National Institutes of Health, Bethesda, MD, AS).
4.7 Mikroskopi Imunofluoresensi
Untuk pewarnaan imunofluoresensi α-catenin oleh α18 yang mengenali α-catenin di bawah tekanan (Nagafuchi dan Tsukita 1994 ), sel difiksasi dengan 1% PFA, dipermeabilisasi dengan 0,2% Triton X-100, dan kemudian diblokir dengan 5% BSA dalam PBS. IgG anti-tikus kambing terkonjugasi Alexa Fluor 488 (A11006, Thermo Fisher Scientific) digunakan sebagai antibodi sekunder. Phalloidin terkonjugasi Alexa Fluor 546 (A22283, Thermo Fisher Scientific) digunakan untuk mewarnai F-actin. Gambar diperoleh menggunakan objektif 60x (PLAPON 60XO, Olympus) dan mikroskop konfokal pemindaian laser (FluoView FV1000, Olympus).



Leave a Reply