Abstrak
LATAR BELAKANG
Tantangan seperti ketidakstabilan metabolik, waktu paruh pendek, penyerapan yang buruk, dan bioavailabilitas rendah dihadapi oleh kandidat obat alami, khususnya dalam ekstrak kompleks yang berasal dari tumbuhan seperti lateks buah ara, yang mengandung banyak senyawa bioaktif yang mempersulit standarisasi dan enkapsulasi. Penelitian ini dilakukan untuk menyelidiki dampak enkapsulasi liposom pada lini sel kanker usus besar manusia HT-29, menggunakan sampel ficin dan lateks yang bersumber secara komersial dari kultivar buah ara Sari Lop dan Aydin Black. Ficin dan lateks buah ara dienkapsulasi melalui hidrasi lapisan tipis, dan sifat karakteristiknya dianalisis. Efek sitotoksik dan apoptosis dari liposom yang disiapkan juga diperiksa pada sel HT-29.
HASIL
Indeks polidispersitas dan potensi zeta liposom konsisten dengan yang dilaporkan dalam literatur, meskipun ukurannya lebih besar dari kisaran yang diinginkan. Nilai persentase efisiensi enkapsulasi (EE%) relatif rendah, berkisar antara 15,5% hingga 23,0%, yang menunjukkan bahwa sebagian besar ficin dan fig latices tetap tidak terenkapsulasi. EE% yang lebih rendah ini mungkin berkontribusi terhadap pengurangan sitotoksisitas yang diamati dalam formulasi yang dienkapsulasi. Ficin dan fig latices yang tidak dienkapsulasi menunjukkan sitotoksisitas yang bergantung pada dosis ( P < 0,05), sementara enkapsulasi secara signifikan menekan toksisitas, kemungkinan karena bioavailabilitas langsung yang terbatas dan pelepasan yang terkendali. Hasil apoptosis, yang dinormalisasi dengan data sitotoksisitas, juga menunjukkan ketergantungan dosis ( P < 0,05) terutama untuk lateks ara hitam Aydin. Perbedaan signifikan dalam apoptosis antara 35 mg L −1 perlakuan lateks buah ara hitam Aydin yang dienkapsulasi dan tidak dienkapsulasi pada 24 dan 48 jam ( masing-masing P = 0,000 dan P = 0,012) lebih lanjut menunjukkan bahwa enkapsulasi liposomal memodulasi baik sitotoksisitas maupun induksi apoptosis, yang berpotensi mengurangi efek di luar target sambil mempertahankan bioaktivitas.
KESIMPULAN
Telah ditetapkan bahwa enkapsulasi liposomal secara signifikan menekan efek sitotoksik dan pro-apoptotik dari ficin dan figlatices. © 2025 Penulis. Jurnal Ilmu Pangan dan Pertanian yang diterbitkan oleh John Wiley & Sons Ltd atas nama Society of Chemical Industry.
PERKENALAN
Kanker kolorektal adalah salah satu jenis kanker yang paling umum, yang menyebabkan lebih dari 700.000 kematian setiap tahunnya. Tantangan utama dalam pengobatan adalah resistensi terhadap kemoterapi. 1 Produk-produk berbasis tanaman dicari karena potensi alaminya untuk mengobati penyakit, seperti yang terlihat dalam pengobatan tradisional. 2 Sebagian besar penelitian obat kanker saat ini berfokus pada senyawa yang berasal dari tanaman. 3 Buah ara, yang tumbuh di daerah beriklim sedang, menghasilkan lateks yang digunakan dalam makanan dan obat-obatan. Lateks buah ara yang tampak seperti susu telah digunakan untuk mengobati kanker, penyakit inflamasi, infeksi, dan kondisi kulit. 4 Ia menawarkan efek antikanker melalui induksi apoptosis dan penghambatan siklus sel. 5 Enzim ficin dari lateks buah ara memiliki aktivitas protease dan peroksidase dan terkait dengan apoptosis sel kanker. 6 , 7 Studi menunjukkan lateks buah ara menghambat proliferasi sel kanker tanpa membahayakan sel-sel sehat, yang menunjukkan potensi antikankernya. 7 – 9 Penelitian terkini menemukan Sari Lop dan Aydin Black Fig dari Turki menunjukkan efek sitotoksik yang bergantung pada dosis dan waktu pada sel kanker prostat dan usus besar, dengan Aydin Black lebih kuat, terutama pada sel HT-29. 10
Kandidat obat alami sering menghadapi tantangan seperti bioavailabilitas dan kelarutan yang buruk yang mengurangi aktivitas biologisnya. 11 Nanoenkapsulasi, khususnya liposom, menawarkan pengiriman yang ditargetkan dan efektivitas yang ditingkatkan karena kesamaan strukturalnya dengan membran sel. 12 , 13 Sementara senyawa herbal liposomal, kurkumin 14 dan naringenin, 15 telah dilaporkan memiliki efek antioksidan dan terapeutik yang meningkat, efek antikanker yang ditingkatkan juga telah ditunjukkan untuk quercetin 16 dan camptothecin yang dienkapsulasi liposom. 17 Selain itu, efek neuroprotektif dan hepatoprotektif dari sediaan liposomal dari senyawa berbasis tanaman, seperti capsaicin, 18 kurkumin, 19 baicalein, 20 dan resveratrol, 21 telah dilaporkan. Studi ini membandingkan efektivitas ficin yang dienkapsulasi liposomal dan yang tidak dienkapsulasi dan fig latices alami pada lini sel kanker usus besar HT-29.
BAHAN DAN METODE
Pengumpulan dan pembekuan lateks buah ara
Daun ara dari Ficus carica L. cv. Sari Lop dan cv. Aydin Black, yang dibudidayakan di Aydin, Turki, dikumpulkan, dikeringkan dalam suhu beku, dan disiapkan sebagai larutan steril untuk aplikasi sel. 10 Ficin yang dikeringkan dalam suhu beku secara komersial (F4165; Sigma, St Louis, MO, AS) yang disiapkan dengan cara yang sama diperoleh.
Analisis sitotoksisitas ficin dan fig latices
Sel kanker usus besar manusia HT-29 dikultur dalam medium RPMI-1640 dengan 100 mL L −1 serum sapi fetal. 10 Sitotoksisitas ficin dan fig latices dinilai menggunakan metode MTT. Berdasarkan penelitian kami sebelumnya, 10 sel HT-29 ditanam 5000 sel per sumur dalam pelat kultur sel transparan 96 sumur. Setelah inkubasi semalam, sel-sel tersebut diobati dengan berbagai konsentrasi ficin (60, 70, 80, dan 100 mg L −1 ) atau fig latices (10, 20, 30, dan 40 mg L −1 ) hingga 72 jam. Konsentrasi ini dipilih karena sebelumnya telah diuji dan ditemukan secara efektif menangkap berbagai respons biologis, yang memungkinkan pengamatan efek sub-mematikan dan mematikan. Kepadatan optik diukur pada 570 nm menggunakan pembaca mikroplat (Bio-Tek, Winooski, VT, AS).
Persiapan liposom
Liposom disiapkan menggunakan metode hidrasi film tipis dengan sedikit modifikasi dari protokol yang telah ditetapkan sebelumnya. 22 , 23 Fosfatidilkolin kedelai terhidrogenasi (HSPC) dan kolesterol dilarutkan dalam campuran kloroform/metanol (3:1 v/v ) pada rasio molar 2:1 untuk memastikan stabilitas membran dan efisiensi enkapsulasi yang optimal. Pelarut diuapkan di bawah tekanan rendah menggunakan sentrifus vakum (Heto Maxi Dry Plus, Alleroed, Denmark) untuk membentuk film lipid tipis, yang selanjutnya dikeringkan di bawah aliran nitrogen 10 menit untuk menghilangkan pelarut sisa sambil membatasi oksidasi. Jika perlu, film lipid kering disimpan pada suhu -20 °C dalam kondisi bebas oksigen untuk menjaga integritas lipid. Untuk hidrasi, lapisan lipid disuspensikan kembali dalam 1 mL salin penyangga fosfat (PBS, pH 7,2) yang dipanaskan hingga 55 °C, yang mengandung lateks ara atau fisin (20 g L −1 ). Campuran tersebut dikenakan ultrasonikasi pada 37 °C selama 10 menit (Bandelin, Berlin, Jerman) untuk memfasilitasi dispersi lipid yang seragam dan enkapsulasi senyawa aktif. Untuk mencapai liposom berukuran nano dan terdistribusi secara homogen, suspensi diekstrusi 15–20 kali melalui filter jarum suntik steril berpori 0,2 μm, menggunakan dua jarum suntik steril yang dipasang saling berhadapan pada filter yang sama. Untuk menghilangkan fisin dan lateks ara yang tidak terenkapsulasi, liposom dimurnikan menggunakan ultrafiltrasi dengan filter sentrifugal Amicon® batas berat molekul (MWCO) 100 kDa (Merck, Darmstadt, Jerman) mengikuti panduan produsen. Singkatnya, campuran disentrifugasi pada 2000 × g selama 10 menit untuk menahan liposom sambil membiarkan senyawa bebas melewatinya. Fraksi yang tertahan dikumpulkan dengan membalik filter dan disentrifugasi pada 1000 × g selama 2 menit. Untuk konsistensi eksperimental, liposom kosong (tanpa ficin atau lateks ara) juga disiapkan menggunakan metode yang sama, mengganti senyawa aktif dengan PBS. Liposom kosong ini digunakan sebagai kontrol untuk mengevaluasi apakah komponen liposomal itu sendiri memengaruhi viabilitas sel. Semua formulasi liposomal disimpan pada suhu 4 °C hingga digunakan lebih lanjut.
Karakterisasi Liposom
Distribusi ukuran hidrodinamik liposom ditentukan menggunakan hamburan cahaya dinamis (DLS) pada sudut hamburan tetap 90° dengan penganalisa partikel Litesizer DLS 500 (Anton Paar, Graz, Austria). Untuk menilai keseragaman ukuran, indeks polidispersitas (PDI) diukur, dengan nilai yang lebih rendah menunjukkan populasi liposom yang lebih homogen. Potensi zeta liposom juga dianalisis untuk mengevaluasi muatan permukaannya, yang memengaruhi stabilitas koloid. Potensi zeta yang lebih tinggi (baik positif maupun negatif) biasanya berkorelasi dengan peningkatan stabilitas karena peningkatan gaya tolak yang mencegah agregasi atau fusi liposom. Sebelum pengukuran, suspensi liposom diencerkan setidaknya 100 kali lipat dalam PBS untuk meminimalkan efek hamburan ganda. Setiap sampel dianalisis dalam rangkap dua untuk memastikan akurasi dan reproduktifitas pengukuran.
Mikroskopi elektron transmisi (TEM) digunakan untuk menilai morfologi dan ukuran liposom seperti yang dijelaskan dalam literatur. 23 Secara singkat, pencitraan dilakukan menggunakan Zeiss Sigma500 FESEM yang dilengkapi dengan detektor SE2 di Fasilitas Inti Mikroskopi Elektron Pusat Biomedik dan Genom Izmir (IBGEM), Izmir, Turki. Sampel liposom dimuat ke dalam kisi tembaga berlapis karbon formvar 100-mesh dan dikeringkan dengan udara pada suhu ruangan. Untuk meningkatkan kontras dan memvisualisasikan detail struktural, sampel diwarnai secara negatif dengan uranil asetat. Gambar TEM diambil untuk memeriksa bentuk, ukuran, dan dispersi liposom, yang memberikan konfirmasi kualitatif tentang integritas strukturalnya.
Aktivitas ficin mirip peroksidase
Aktivitas ficin yang mirip peroksidase dinilai secara spektrofotometri pada 652 nm menggunakan 3,3′,5,5′-tetrametilbenzidina (TMB) sebagai substrat, dengan aktivitas ficin yang dienkapsulasi dan lateks ficin dibandingkan dengan kurva kalibrasi ficin standar. Reaksi dilakukan dengan mengikuti protokol spektrofotometri yang dimodifikasi berdasarkan penelitian sebelumnya. 10 , 24 Secara singkat, 20 mg L −1 lateks F. carica dicampur secara berurutan dengan 20 μL PBS (pH 5), 20 μL TMB 8 mmol L −1 (Sigma-Aldrich, St Louis, MO, AS), dan 20 μL hidrogen peroksida 8 mmol L −1 . Volume reaksi akhir disesuaikan menjadi 200 μL dengan air suling, dan campuran diinkubasi pada suhu 30 °C selama 2 jam untuk memungkinkan terjadinya perkembangan warna. Absorbansi kemudian diukur pada 652 nm, dan nilai yang diperoleh dibandingkan dengan kurva standar ficin untuk mengukur aktivitas seperti peroksidase.
Efisiensi enkapsulasi lateks buah ara liposomal dan ficin
Persentase efisiensi enkapsulasi (EE%) dihitung dengan mengukur aktivitas mirip peroksidase, menggunakan grafik ficin standar untuk konversi. Persamaan berikut digunakan untuk menghitung EE%.

Analisis sitotoksisitas dan apoptosis lateks buah ara liposomal dan ficin
Sel HT-29 ditanam 10.000 sel per sumur dalam pelat kultur sel putih 96 sumur dan diinkubasi semalam. Keesokan harinya, sel-sel tersebut diobati dengan ficin yang tidak dienkapsulasi atau dienkapsulasi (0, 90, 120, dan 150 mg L −1 ) atau fig latices (0, 15, 25, dan 35 mg L −1 ) hingga 48 jam. Konsentrasi ini dipilih berdasarkan hasil MTT yang dijelaskan sebelumnya. Viabilitas sel dinilai menggunakan kit Uji Viabilitas Sel Luminescent CellTiter-Glo® (Promega, Madison, WI, AS). 25 Luminometer LuMate 4400 digunakan untuk pengukuran (Awareness Technology, Palm City, FL, AS). Sel yang tidak diobati (0 mg L −1 ) disertakan sebagai kontrol negatif untuk menetapkan viabilitas dasar dan menghilangkan efek latar belakang. Sel yang diobati dengan liposom kosong berfungsi sebagai kontrol tambahan untuk menilai potensi efek sitotoksik dari pembawa liposomal. Konsentrasi tertinggi ficin (100 mg L −1 ) dan fig latices (40 mg L −1 ) digunakan sebagai titik referensi untuk sitotoksisitas maksimum tanpa adanya kontrol positif kemoterapi standar.
Untuk pengukuran apoptosis, sel-sel HT-29 dipersiapkan dengan cara yang sama dalam pelat kultur sel 96-well putih dan diobati dengan ficin yang tidak dienkapsulasi atau dienkapsulasi (0, 90, 120, dan 150 mg L −1 ) atau fig latices (0, 15, 25, dan 35 mg L −1 ) hingga 48 jam. Tingkat apoptosis dinilai menggunakan kit Uji Caspase-Glo® 3/7 (Promega), yang mengukur aktivitas caspase-3/7 sebagai indikator kematian sel apoptosis, dengan mengikuti petunjuk pabrik. Sinyal luminesensi direkam menggunakan luminometer LuMate 4400 (Awareness Technology), dan nilai apoptosis dinormalisasi dengan viabilitas sel untuk memperhitungkan variasi dalam jumlah sel. Untuk mengendalikan sinyal latar belakang potensial, well media-sendiri (tanpa sel) disertakan untuk mengurangi luminesensi non-spesifik. Selain itu, sel yang tidak diobati (0 mg L −1 ) berfungsi sebagai kontrol negatif untuk menetapkan tingkat apoptosis dasar, sementara sel yang diobati dengan liposom kosong digunakan untuk menilai potensi efek apoptosis dari pembawa liposomal saja.
Analisis data
Percobaan diulang tiga kali. SPSS Statistics 20.0 (IBM, Armonk, NY, AS) digunakan untuk evaluasi statistik. Perbedaan antar kelompok ditentukan dengan analisis varians (ANOVA), dan uji perbandingan berganda Duncan diterapkan untuk menentukan tingkat signifikansi perbedaan ( P < 0,05).
HASIL
Sitotoksisitas oleh ficin dan fig latices
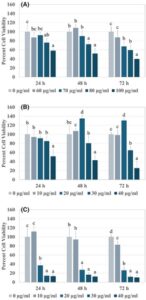
Ficin, Sari Lop, dan Aydin Black fig latices diuji pada sel kanker usus besar HT-29 selama 24, 48, dan 72 jam (Gbr. 1(A)–(C) ). Sitotoksisitas meningkat dengan dosis pengobatan ( P < 0,05). Dosis tertinggi (100 mg L −1 untuk ficin dan 40 mg L −1 untuk ficin) menunjukkan toksisitas terbesar. Tidak ada perbedaan signifikan dalam sitotoksisitas yang diamati dari waktu ke waktu untuk dosis tertinggi ini ( P = 0,053, 0,131, dan 0,647 untuk ficin, Sari Lop, dan Aydin Black fig latices, berturut-turut).
Analisis fisik liposom
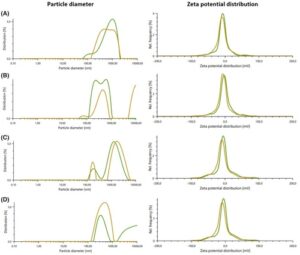
Ukuran hidrodinamik, PDI, dan potensi zeta dari empat jenis liposom diukur (Gbr. 2 dan Tabel 1 ). Perbedaan signifikan ditemukan pada potensi PDI dan zeta ( P = 0,029 dan 0,000), tetapi tidak pada ukuran ( P = 0,277). Gambar TEM mengonfirmasi adanya variasi ukuran (Gbr. 3 ).
| Ukuran hidrodinamik (nm) | Indeks polidispersitas (PDI) (%) | Potensi zeta (mV) | |
|---|---|---|---|
| Kontrol | 821,3 ± 197,6 jam | 28,6 ± 2,3 jam | -15,2 ± 0,2 satuan |
| Ficin | 1803,4 ± 936,9 tahun | 38,1 ± 6,5 tahun | -10,2 ± 0,4 miliar |
| Sari Lop | 1169,8 ± 186,3 tahun | 35,7 ± 3,2 miliar | -10,0 ± 1,0 b |
| Aydin Hitam | 1372,8 ± 951,3 tahun | 36,3 ± 2,7 miliar | -10,0 ± 1,0 b |
Huruf superskrip yang berbeda menunjukkan P < 0,05 menurut uji perbandingan berganda Duncan.

Efisiensi enkapsulasi ficin liposomal dan figlatices
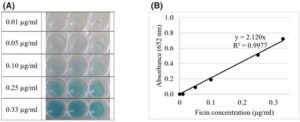
Konsentrasi ficin ditentukan dengan mengukur warna biru yang terbentuk oleh aktivitas seperti peroksidase (Gbr. 4 ). Konsentrasi ficin dalam liposom dihitung menjadi 101,3, 37,5, dan 28,9 g L −1 untuk liposom berisi ficin, lateks ara Sari Lop, dan lateks ara Aydin Black (Tabel 2 ) yang menghasilkan EE% masing-masing sebesar 23,0%, 20,1%, dan 15,5%, dengan yang terakhir secara signifikan lebih rendah ( P < 0,05). Konsentrasi ficin lebih rendah dalam liposom lateks ara karena bahan non-ficin dalam lateks. Nasib ficin juga diikuti dalam filtrat dan efluen selama prosedur produksi liposom. Tabel 3 menunjukkan bagaimana 23% dari jumlah awal ficin berhasil dienkapsulasi dalam liposom dan dalam langkah mana sisanya hilang.
| Konsentrasi (mg/mL) | Jumlah (mg) | Efisiensi enkapsulasi (%) | |
|---|---|---|---|
| Ficin | 101,3 ± 4,8 detik | 4,6 ± 0,2 miliar | 23,0 ± 1,0 miliar |
| Sari Lop | 37,5 ± 4,2 inci | 4,0 ± 0,3 miliar | 20,1 ± 1,7 miliar |
| Aydin Hitam | 28,9 ± 3,4 jam | 3,1 ± 0,4 satuan | 15,5 ± 1,8 jam |
Huruf superskrip yang berbeda menunjukkan P < 0,05 menurut uji perbandingan berganda Duncan.
| Langkah-langkah dalam persiapan liposom | Ficin ditahan mg (%) | Ficin hilang mg (%) |
|---|---|---|
| Jumlah awal ficin | 20.0 (100.0) | – |
| Setelah ekstrusi | 14.3 (71.5) | -5,7 (-28,5) |
| Kehilangan filtrat setelah sentrifus | 4.8 (24.0) | -9,5 (-47,5) |
| Suspensi liposom akhir | 4.6 (23.0) | -0,2 (-1,00) |
Angka yang dicetak tebal dihitung berdasarkan aktivitas seperti peroksidase. Angka lainnya merupakan perkiraan, bukan pengukuran.
Perbandingan sitotoksisitas ficin dan figlatices yang dienkapsulasi dan tidak dienkapsulasi
Ficin yang dienkapsulasi dan tidak dienkapsulasi, Sari Lop, dan Aydin Black fig latices diuji pada sel HT-29 selama 24 dan 48 jam (Gbr. 5(A)–(C) ). Perlakuan yang tidak dienkapsulasi menunjukkan sitotoksisitas yang bergantung pada dosis ( P < 0,05) yang memvalidasi Gbr. 1 , sedangkan perlakuan yang dienkapsulasi tidak menunjukkannya.

Perbandingan uji- t pada hasil sitotoksisitas ficin 150 mg L −1 yang dienkapsulasi dan tidak dienkapsulasi selama 24 dan 48 jam menunjukkan adanya perbedaan yang bermakna secara statistik dengan P = 0,012 dan P = 0,019 masing-masing untuk 24 dan 48 jam (Gambar 5(A) ). Demikian pula, perbedaan signifikan juga diamati antara hasil sitotoksisitas lateks buah ara Sari Lop yang dienkapsulasi dan yang tidak dienkapsulasi 35 mg L −1 ( P = 0,028 dan P = 0,048 selama 24 dan 48 jam, berturut-turut) (Gbr. 5(B) ), dan antara hasil sitotoksisitas lateks buah ara Aydin Black yang dienkapsulasi dan yang tidak dienkapsulasi 35 mg L −1 ( P = 0,001 dan P = 0,000 selama 24 dan 48 jam, berturut-turut) (Gbr. 5(C) ). Selain itu, hasil uji perbandingan berganda Duncan post hoc untuk setiap kelompok ditunjukkan dengan huruf di atas batang pada Gbr. 5 .
Perbandingan apoptosis ficin dan figlatices yang dienkapsulasi dan tidak dienkapsulasi
Apoptosis diukur pada sel HT-29 yang diobati dengan ficin yang dienkapsulasi dan tidak dienkapsulasi, Sari Lop, dan Aydin Black fig latex selama 24 dan 48 jam (Gbr. 6(A)–(C) ). Berdasarkan hasil apoptosis yang dinormalisasi, pengobatan yang tidak dienkapsulasi menunjukkan apoptosis yang bergantung pada dosis ( P < 0,05), terutama untuk Aydin Black fig latex.

Perbandingan uji- t pada hasil apoptosis ficin 150 mg L −1 yang dienkapsulasi dan yang tidak dienkapsulasi selama 24 dan 48 jam menunjukkan perbedaan yang signifikan secara statistik dengan P = 0,004 dan P = 0,036 masing-masing selama 24 dan 48 jam (Gbr. 6(A) ). Perbedaan signifikan juga diamati antara hasil apoptosis 24 jam dari lateks ara Sari Lop yang dienkapsulasi dan yang tidak dienkapsulasi ( P = 0,007), namun, tidak cukup data yang tersedia untuk menjamin signifikansi untuk pengobatan 48 jam ( P = 0,509) (Gbr. 6(B) ). Perbedaan antara hasil apoptosis dari lateks ara hitam Aydin yang dienkapsulasi dan tidak dienkapsulasi 35 mg L −1 juga signifikan yang menunjukkan keberhasilan atenuasi dengan enkapsulasi liposom ( P = 0,000 dan P = 0,012 masing-masing selama 24 dan 48 jam) (Gbr. 6(C) ). Selain itu, hasil uji perbandingan berganda Duncan post hoc untuk setiap kelompok ditunjukkan dengan huruf di atas garis pada Gbr. 6 .
DISKUSI
Sitotoksisitas oleh ficin dan fig latices
Perlakuan ficin 100 mg L −1 menurunkan viabilitas sel HT-29 menjadi 58,1% dalam 24 jam, 51,8% dalam 48 jam, dan 39,8% dalam 72 jam. Sejauh pengetahuan kami, ini adalah studi pertama yang melaporkan toksisitas ficin pada lini sel HT-29. Lateks buah ara Sari Lop (40 mg L −1 ) menurunkan viabilitas sel menjadi 51,5% pada 24 jam, 43,0% pada 48 jam, dan 25,5% pada 72 jam. Lateks buah ara hitam Aydin (40 mg L −1 ) menurunkan viabilitas menjadi 13,3% pada 24 jam, 12,5% pada 48 jam, dan 10,5% pada 72 jam. Lateks buah ara hitam Aydin menunjukkan sitotoksisitas yang lebih tinggi daripada lateks buah ara Sari Lop. Temuan ini konsisten dengan penelitian sebelumnya yang diterbitkan oleh kelompok kami, yang juga menunjukkan bahwa lateks buah ara Aydin Black memiliki efek sitotoksik yang lebih besar pada lini sel HT-29 daripada lateks buah ara Sari Lop. 10 Selain itu, Soltana et al . 1 menganalisis efek lateks buah ara varietas Kholi pada lini sel HT-29, melaporkan bahwa konsentrasi 182 mg L −1 dan 503 mg L −1 diperlukan untuk membunuh 50% sel pada 48 dan 24 jam, masing-masing. Hasil penelitian saat ini menunjukkan bahwa lateks buah ara dan ficin menunjukkan efek sitotoksik pada lini sel HT-29. Lebih jauh, diamati bahwa tingkat sitotoksisitas bervariasi tergantung pada varietas buah ara.
Aktivitas ficin mirip peroksidase
Peroksidase mengkatalisis oksidasi hidrogen peroksida menjadi radikal hidroksil yang terlibat dalam pertukaran elektron dengan substrat yang menghasilkan warna setelah oksidasi. Aktivitas seperti peroksidase bervariasi tergantung pada faktor-faktor seperti suhu, pH, waktu, hidrogen peroksida, dan konsentrasi TMB. 26 pH optimal untuk menentukan aktivitas seperti peroksidase ficin adalah 5,0, dan aktivitas tersebut tidak dapat diukur pada pH 7,0 dan di atasnya. 26 Dalam penelitian saat ini, larutan penyangga dengan nilai pH 5,0 dan 7,2 digunakan. Namun, tidak ada pembentukan warna biru yang diamati pada pH 7,2.
Suhu inkubasi optimal dilaporkan sebesar 30 °C, 24 dan 35 °C, 27 sehingga 30 °C dan 35 °C diuji dalam penelitian ini dan hanya hasil yang diperoleh pada suhu 30 °C yang disajikan di sini karena dianggap yang terbaik. Sinyal aktivitas seperti peroksidase dilaporkan meningkat selama 2 jam dan kemudian tetap konstan. 24 Tren serupa diamati dalam penelitian saat ini sehingga data 2 jam disajikan.
Terakhir, lateks buah ara dilaporkan mengandung sekitar 9% fisin. 28 Parameter yang sama yang ditentukan untuk fisin diterapkan saat mengukur aktivitas mirip peroksidase pada lateks buah ara. Setelah memeriksa nilai absorbansi dan pembentukan warna, dihipotesiskan bahwa reaksi yang berbeda dari yang dilakukan oleh enzim fisin juga dapat terjadi dalam pengukuran lateks buah ara karena pembentukan warna biru diamati pada awalnya. Namun, pada dosis lateks buah ara yang tinggi, perubahan warna mulai dari hijau hingga kuning diamati.
Persiapan liposom
Enkapsulasi dengan liposom merupakan metode yang tepat untuk melindungi enzim dari denaturasi dan proteolisis serta menstabilkannya. Chaize dkk . 29 menganalisis parameter yang terlibat dalam setiap langkah dari berbagai prosedur enkapsulasi untuk mencapai hasil enkapsulasi yang optimal. Mereka melaporkan bahwa, meskipun hasil enkapsulasi rendah, teknik hidrasi lapisan tipis merupakan satu-satunya metode yang mencegah denaturasi protein. 29 Dalam penelitian kami, metode hidrasi lapisan tipis digunakan untuk persiapan liposom untuk enzim ficin dan figlatices, dengan sedikit modifikasi berdasarkan metode yang dijelaskan dalam literatur. 22
Analisis ukuran partikel liposomal
Ukuran partikel dan nilai PDI dari sistem nanocarrier sangat penting untuk penyerapan seluler melalui endositosis. 30 Santos et al . 12 menyarankan nanopartikel harus berukuran 5–200 nm untuk menghindari risiko emboli, dengan ukuran ideal 70–200 nm untuk pengobatan kanker. 31 Dalam penelitian kami, ukuran hidrodinamik liposom untuk kontrol, ficin, Sari Lop, dan Aydin Black masing-masing adalah 821,3 ± 197,6, 1803,4 ± 936,9, 1169,8 ± 186,3, dan 1372,8 ± 951,3 nm (Tabel 1 ), melebihi nilai target. Sedangkan ukuran liposom yang diamati dalam gambar TEM (Gbr. 3 ) agak lebih kecil daripada pengukuran zetasizer, yang sebagian dapat dijelaskan oleh sifat metode DLS yang digunakan oleh zetasizer. 32 DLS mengukur diameter hidrodinamik, yang mencakup liposom itu sendiri dan juga lapisan air yang berdekatan di luar liposom. Muatan permukaan dan efek gerak Brown mungkin beraksi. Namun, TEM secara langsung memvisualisasikan liposom dalam keadaan dehidrasi di bawah vakum. Oleh karena itu, mengamati ukuran yang lebih kecil dengan TEM dapat dijelaskan. Selain itu, gambar TEM mungkin tidak mencerminkan ukuran partikel rata-rata sampel karena diambil di area di mana partikel liposom tidak padat untuk menunjukkan bentuk individual. Liposom besar memiliki pro dan kontra. Mereka menyediakan lebih banyak ruang untuk obat tetapi pelepasannya lebih lambat. 33 Ukurannya bervariasi tergantung pada jumlah fosfolipid, kolesterol, dan obat-obatan. Basavaraj dan Betageri 34 menemukan distribusi ukuran yang baik dalam liposom dengan rasio distearoil fosfatidilkolin dan kolesterol spesifik, sementara Umbarkar et al . 33 melaporkan bahwa ukuran liposom meningkat seiring dengan konsentrasi obat.
PDI adalah parameter penting lain yang mengukur distribusi ukuran partikel, di mana nilai yang lebih rendah lebih disukai. 33 , 35 Nilai PDI kami adalah 28,6% ± 2,3 untuk kontrol, 38,1% ± 6,5 untuk ficin, 35,7% ± 3,2 untuk Sari Lop, dan 36,3% ± 2,7 untuk Aydin Black, sesuai dengan nilai yang disarankan. Potensi zeta menunjukkan muatan permukaan, yang memengaruhi stabilitas, dengan rentang di atas +30 mV atau di bawah −30 mV ideal. 36 Nilai kami adalah −15,2 ± 0,2 untuk kontrol, −10,2 ± 0,4 untuk ficin, −10,0 ± 1,0 untuk Sari Lop, dan −10,0 ± 1,0 untuk Aydin Black, yang menunjukkan stabilitas suboptimal, meskipun cukup. Stabilitas liposom sangat penting untuk memastikan distribusi seragam lateks buah ara dan ficin yang dienkapsulasi sambil meningkatkan bioavailabilitasnya, dan mengoptimalkan kemanjuran terapi.
Konsentrasi dan efisiensi enkapsulasi ficin liposomal dan figlatices
Liposomal ficin dan fig latex diencerkan dalam PBS, dan aktivitas seperti peroksidase diukur. Sampel dari persiapan liposom, termasuk sebelum dan sesudah ekstrusi dan filtrat yang dipisahkan menggunakan filter Amicon, juga dianalisis. Menggunakan kurva kalibrasi (Gbr. 4(B) ), konsentrasi liposom, jumlah ficin, dan efisiensi enkapsulasi dihitung. Untuk persiapan, 20 g L −1 fig latex dan enzim ficin digunakan, menghasilkan nilai konsentrasi 37,5, 28,9, dan 101,3 g L −1 untuk liposomal Sari Lop, Aydin Black, dan ficin, masing-masing. Nilai EE% adalah 20,1%, 15,5%, dan 23,0%. Uji coba dengan 10 g L −1 ficin menunjukkan nilai EE% sebesar 12,9%. Konsentrasi ficin yang lebih tinggi meningkatkan efisiensi enkapsulasi. Niu et al . 37 mencatat efisiensi enkapsulasi kurkumin yang rendah karena nilai pH buffer yang berbeda. Untuk sel kanker, yang memerlukan pH 7,2–7,4, 38 penelitian kami menggunakan buffer PBS pH 7,2. Chaize et al . 29 melaporkan bahwa metode hidrasi film tipis dapat menghasilkan efisiensi enkapsulasi yang rendah, yang kami gunakan untuk mencegah denaturasi fisin. Dengan demikian, berbagai faktor dapat memengaruhi efisiensi enkapsulasi.
Perbandingan sitotoksisitas ficin dan figlatices yang dienkapsulasi dan tidak dienkapsulasi
Efek ficin liposomal dan ficin pada lini sel HT-29 ditentukan menggunakan metode luminescence, dengan konsentrasi ficin 0, 90, 120, dan 150 mg L −1 yang diaplikasikan hingga 48 jam. Pada 150 mg L −1 , ficin menunjukkan tingkat viabilitas sel sebesar 79,1% pada 24 jam dan 53,7% pada 48 jam, sedangkan ficin liposomal memiliki viabilitas masing-masing sebesar 99,1% dan 93,8%. Demikian pula, efek lateks buah ara liposomal dan lateks buah ara diuji, dengan konsentrasi 0, 15, 25, dan 35 mg L −1 . Pada 35 mg L −1 , lateks buah ara Sari Lop menunjukkan viabilitas 75,6% pada 24 jam dan 45,4% pada 48 jam, sedangkan Sari Lop liposomal masing-masing memiliki 105,0% dan 88,1%. Lateks buah ara Aydin Black menunjukkan viabilitas 33,4% dan 18,3%, sedangkan Aydin Black liposomal memiliki 115,9% dan 96,3% pada 24 dan 48 jam, masing-masing. Bentuk yang dienkapsulasi menunjukkan sitotoksisitas yang lebih rendah dibandingkan dengan bentuk yang tidak dienkapsulasi. Zalba et al . 39 melaporkan sitotoksisitas oksaliplatin liposomal yang berkurang pada sel HT-29, mirip dengan temuan kami. Metode luminesensi menunjukkan sitotoksisitas yang berkurang dibandingkan dengan uji MTT. Perbedaan ini mungkin tidak semata-mata disebabkan oleh metode tetapi juga kondisi penyimpanan, seperti lateks buah ara beku-kering dan fisin disimpan pada suhu -20 °C untuk pengujian MTT, sementara dalam metode pendaran cahaya, lateks buah ara dan fisin disimpan pada suhu +4 °C bersama dengan formulasi liposomal karena pembekuan tidak direkomendasikan untuk liposom.
Pengurangan aktivitas yang serupa juga telah diamati dengan amfoterisin B (AmB), obat antijamur spektrum luas yang banyak digunakan untuk pengobatan infeksi jamur sistemik. Namun, aplikasi klinisnya telah dibatasi secara signifikan oleh efek samping yang parah, khususnya nefrotoksisitas. Formulasi berbasis lipid telah dikembangkan untuk meningkatkan pengiriman obat sambil mengurangi toksisitas. 40 , 41 Formulasi ini mengubah distribusi obat, memungkinkan akumulasi yang lebih tinggi di tempat infeksi sambil meminimalkan paparan ginjal, sehingga meningkatkan tolerabilitas dan hasil pasien. 42 , 43 Temuan pada formulasi AmB berbasis lipid selaras dengan hasil kami pada ficin liposomal dan fig latices, karena kedua studi menunjukkan bahwa enkapsulasi liposomal secara efektif mengurangi toksisitas sambil mempertahankan bioaktivitas. Sama seperti pembawa lipid dalam formulasi AmB meminimalkan nefrotoksisitas dengan mengubah distribusi obat dan mengurangi paparan ginjal langsung, penelitian kami menunjukkan bahwa ficin liposomal dan fig latex menunjukkan sitotoksisitas yang lebih rendah dibandingkan dengan bentuk yang tidak dienkapsulasi, kemungkinan karena pelepasan yang terkontrol dan bioavailabilitas langsung yang berkurang. Selain itu, mirip dengan bagaimana formulasi AmB berbasis lipid mempertahankan khasiat antijamur dengan efek samping yang lebih sedikit, temuan kami menunjukkan bahwa enkapsulasi liposomal memodulasi aktivitas ficin dan fig latex, yang berpotensi mengurangi efek samping sekaligus mempertahankan potensi terapeutik.
Perbandingan apoptosis ficin dan figlatices yang dienkapsulasi dan tidak dienkapsulasi
Efek apoptotik ficin dan fig latices pada sel HT-29 diukur dengan aktivitas efektor caspases 3 dan 7. Ficin menunjukkan peningkatan 1,3 kali lipat dalam tingkat apoptosis setelah 24 jam, sementara formulasi liposomal menunjukkan penurunan apoptosis dibandingkan dengan kontrol. Getah ara Sari Lop menyebabkan peningkatan 1,3 kali lipat setelah 24 jam dan peningkatan 1,4 kali lipat setelah 48 jam, dengan formulasi liposomal menunjukkan penurunan pada 24 jam dan peningkatan 1,21 kali lipat pada 48 jam. Getah ara Aydin Black menyebabkan peningkatan 1,8 kali lipat pada 24 jam dan peningkatan 3,0 kali lipat pada 48 jam, dengan penurunan dalam formulasi liposomal pada kedua waktu tersebut. Secara keseluruhan, tidak ada perubahan dramatis dalam tingkat apoptosis yang diamati dengan formulasi liposomal, tetapi lateks ara Aydin Black yang tidak dienkapsulasi secara signifikan meningkatkan apoptosis. Penelitian sebelumnya telah mengkonfirmasi temuan ini, yakni 10 kali lipat tingkat apoptosis dengan lateks buah ara hitam Aydin dibandingkan dengan lateks buah ara Sari Lop.
Studi terkini memberikan wawasan awal mengenai efek sitotoksik dan apoptotik dari lateks ara yang dienkapsulasi liposom dan fisin pada sel kanker usus besar manusia HT-29. Jika dibandingkan dengan lateks ara yang tidak dienkapsulasi dan fisin, formulasi liposomal dari fisin dan lateks ara mungkin menjanjikan sebagai agen terapeutik yang potensial. Namun, karena keterbatasan inheren dari studi in vitro , termasuk penggunaan satu lini sel, tidak adanya validasi in vivo , dan kurangnya pemahaman mekanistik yang komprehensif, temuan ini harus ditafsirkan dengan hati-hati. Penelitian lebih lanjut pada lini sel kanker dan sel normal yang lebih luas diperlukan untuk menentukan spesifisitas dan penerapan yang lebih luas dari formulasi liposomal ini. Selain itu, mengeksplorasi efeknya melalui studi in vivo akan sangat penting untuk menilai potensinya dengan lebih baik. Secara keseluruhan, meskipun hasilnya menjanjikan, hasilnya merupakan awal dari serangkaian penelitian yang lebih besar yang ditujukan untuk mengembangkan terapi kanker yang baru dan efektif.
Keterbatasan
Meskipun penelitian ini memberikan wawasan berharga mengenai sitotoksisitas dan efek apoptosis ficin dan fig latex yang dienkapsulasi liposom, beberapa keterbatasan perlu dipertimbangkan. Pertama, meskipun enkapsulasi liposomal meningkatkan stabilitas dan pelepasan senyawa yang terkontrol, ukuran liposom melebihi kisaran ideal untuk penyerapan seluler yang optimal. Ukuran liposom yang lebih besar, seperti yang ditunjukkan oleh analisis DLS dan TEM, dapat memengaruhi kemampuannya untuk memasuki sel kanker secara efisien, sehingga berpotensi mengurangi efek terapeutik. Selain itu, efisiensi enkapsulasi relatif rendah, terutama untuk lateks ara hitam Aydin, yang dapat membatasi efektivitas keseluruhan formulasi liposomal. Keterbatasan lain dari penelitian ini adalah kurangnya data in vivo , karena hasilnya didasarkan pada pengamatan in vitro menggunakan lini sel kanker usus besar HT-29. Penelitian in vivo diperlukan untuk mengonfirmasi efektivitas, biodistribusi, dan potensi toksisitas formulasi liposomal dalam seluruh organisme. Lebih jauh lagi, penggunaan hanya satu lini sel (HT-29) membatasi generalisasi temuan ke jenis kanker atau model sel lainnya. Akhirnya, meskipun formulasi liposom menunjukkan hasil yang menjanjikan dalam mengurangi sitotoksisitas dan apoptosis dibandingkan dengan perawatan yang tidak dienkapsulasi, pengoptimalan lebih lanjut dari formulasi, seperti meningkatkan efisiensi enkapsulasi, mengendalikan ukuran partikel, dan mengeksplorasi komposisi liposom yang berbeda, dapat meningkatkan potensi terapeutik senyawa ini.




Leave a Reply