Ringkasan
Reseptor seperti kinase FERONIA (FER) adalah anggota utama dari keluarga Catharanthus roseus RLK1 (CrRLK1L), berfungsi sebagai modulator pembentukan kompleks kinase reseptor imun sebagai respons terhadap faktor alkalinisasi cepat (RALF). Biasanya, FER mengenali RALF ekstraseluler dewasa untuk melawan infeksi bakteri dan jamur. Namun, peran apa pun dari kaskade pensinyalan FER-RALF dalam infeksi virus tanaman masih belum dieksplorasi. Di sini, kami menggunakan virus mosaik lobak (TuMV), anggota penting dari genus Potyvirus , dan inang Nicotiana benthamiana sebagai sistem model untuk mengeksplorasi peran kaskade FER-RALF dalam interaksi tanaman-virus. RALF1 dari N. benthamiana (NbRALF1) secara positif mengatur resistensi inang untuk menghambat infeksi TuMV. Studi ko-ekspresi menunjukkan bahwa proses ini tidak melibatkan motif RRXL dan YISY yang dilestarikan yang biasanya dikaitkan dengan fungsi RALF. Sebaliknya, NbRALF1 menginduksi kematian sel dan secara signifikan menghambat infeksi TuMV dengan cara yang bergantung pada seluruh urutan RALF1 dan juga NbFER. Hasil ini menunjukkan mekanisme baru di mana NbRALF1 dapat menghambat infeksi virus melalui interaksi intraseluler dengan NbFER, berbeda dari interaksi FER-RALF ekstraseluler yang dilaporkan sebelumnya yang menginduksi resistensi terhadap jamur dan bakteri. Lebih jauh, kami menemukan bahwa TuMV 6K2 berinteraksi dengan NbRALF1 dan mendorong degradasinya melalui jalur proteasom 26S, sehingga menangkal resistensi inang yang diinduksi oleh kaskade NbFER-NbRALF1. Temuan kami menyiratkan adanya jalur pensinyalan imunitas intraseluler yang tidak berkarakter yang dimediasi oleh kaskade NbFER-NbRALF1 dan mengungkapkan mekanisme yang digunakan virus tanaman untuk menangkal imunitas yang dimediasi modul RALF1-FER.
Perkenalan
Komunikasi sel-ke-sel sangat penting bagi tanaman, karena mereka adalah organisme sesil yang harus beradaptasi dengan lingkungan yang terus berubah. Hormon peptida tanaman memainkan peran penting dalam proses ini, dengan peptida faktor alkalinisasi cepat (RALF) yang disekresikan dan berukuran kecil (sekitar 5 kDa) menjadi sangat penting (Murphy et al ., 2012 ). RALF termasuk dalam famili hormon peptida tanaman yang kaya sisteina dan memainkan peran penting dalam banyak proses fisiologis dan perkembangan, mulai dari reproduksi dan perkembangan tanaman hingga modulasi respons imun (Abarca et al ., 2021 ; Cheung, 2024 ; Haruta et al ., 2014 ; Stegmann et al ., 2017 ).
RALF pertama kali ditemukan karena mereka menginduksi alkalinisasi sedang dalam kultur sel Nicotiana tabacum (Pearce et al ., 2001 ). Mereka sekarang diketahui tersebar luas di antara tanaman terestrial, dengan mayoritas studi fungsional difokuskan pada tanaman model Arabidopsis, serta pada tanaman seperti padi ( Oryza sativa ), gandum ( Triticum aestivum ), jagung ( Zea mays ), kedelai ( Glycine max ), dan lobak ( Brassica rapa ). Dalam Arabidopsis thaliana , lebih dari 30 peptida RALF telah diidentifikasi (Abarca et al ., 2021 ). Meskipun kesamaan asam amino rendah, peptida RALF berbagi beragam motif terkonservasi yang penting untuk fungsinya. Motif-motif ini meliputi: (i), motif RR dibasik, yang penting untuk pembelahan proteolitik prekursor peptida (Matos et al ., 2008 ; Srivastava et al ., 2009 ); (ii) motif YI/LSY N-terminal dari peptida matang, yang penting untuk pengikatan reseptor dan aktivitas alkalinisasi (Pearce et al ., 2010 ; Xiao et al ., 2019 ); (iii) empat residu sisteina terkonservasi di wilayah C-terminal RALF, yang membentuk ikatan disulfida dan penting untuk bioaktivitas peptida (Pearce et al ., 2001 ).
RALF adalah protein eksositosis khas yang mengalami pematangan melalui pembelahan spesifik di situs N-terminus RRXL oleh enzim proteolitik dalam aparatus Golgi (Matos et al ., 2008 ; Srivastava et al ., 2009 ). Proses ini sangat penting untuk aktivasi RALF. Dalam Arabidopsis, Site-1-Protease (S1P) memainkan peran kunci dalam proses pematangan ini (Srivastava et al ., 2009 ; Stegmann et al ., 2017 ). Setelah matang, RALF dilepaskan ke dalam apoplas ekstraseluler, tempat mereka dapat berinteraksi dengan reseptornya, seperti FERONIA (FER), reseptor kinase terkenal yang termasuk dalam keluarga Catharanthus roseus RLK1 (CrRLK1) (Stegmann et al ., 2017 ; Xiao et al ., 2019 ). FER memiliki domain pengikat ligan ekstraseluler (ECD), diikuti oleh satu heliks transmembran dan domain kinase sitoplasma (CD) yang relatif terkonservasi dengan baik. Model umum menunjukkan bahwa FER mampu merasakan dan mengenali RALF melalui ECD-nya, yang kemudian memicu fosforilasi CD dan selanjutnya merekrut substrat intraseluler spesifik untuk memulai kaskade pensinyalan hilir (Li et al ., 2016 ; Stegmann et al ., 2017 ).
Modul RALF-FER berfungsi melalui berbagai mekanisme, termasuk pensinyalan kalsium, interaksi hormon, dan produksi spesies oksigen reaktif (ROS) (Cheung, 2024 ; Guo et al ., 2018 ; Kwon et al ., 2024 ), yang memainkan peran penting dalam interaksi tanaman–mikroba. Misalnya, modul RALF23-FER di Arabidopsis menekan perakitan kompleks imun yang diinduksi flagelin pola molekuler bakteri EFR-FLS2-BAK1, sehingga menghambat transmisi sinyal imun hilir seperti ledakan ROS dan kaskade mitogen-activated protein kinase (MAPK), dan meningkatkan sensitivitas Arabidopsis terhadap Pseudomonas syringae pv. tomato DC3000 (pst DC3000) (Stegmann et al ., 2017 ). AtRALF23 juga dapat menekan fosforilasi MYC2 yang dimediasi AtFER, sehingga menstabilkan MYC2 dan meningkatkan pensinyalan JA untuk mengatur kekebalan tanaman secara negatif terhadap infeksi pst DC3000 (Guo et al ., 2018 ). Baru-baru ini, sebuah karya perintis mengungkapkan bahwa setelah mendeteksi kolonisasi bakteri yang tinggi, RALF23 dewasa mengakumulasi dan mengaktifkan Zinc metalloproteinase At2-MMP untuk memicu pembelahan domain sitoplasma FER, yang menghasilkan FERN. Fragmen yang terbelah ini terakumulasi dalam nukleus dan meningkatkan ekspresi gen terkait kekebalan di wilayah akar yang terbatas untuk melindungi terhadap invasi mikroba (Chen et al ., 2024 ). Demikian pula, AtRALF22 memainkan peran langsung dan positif dalam respons imun, memunculkan berbagai respons imun khas dengan cara yang bergantung pada FER untuk meningkatkan resistensi Arabidopsis terhadap Sclerotinia sclerotiorum (He et al ., 2023 ). Peran kompleks RALF1-FER dalam infeksi tanaman-mikroba jarang diselidiki. RALF1 dapat bekerja dengan FER untuk memfosforilasi protein pengikat RNA kaya glisin 7 (GRP7) untuk meningkatkan akumulasi inti GRP7 dan memicu penyambungan alternatif RNA (AS) yang cepat dan masif di A. thaliana ( Wang et al ., 2020 ). AS telah dilaporkan memainkan peran penting dalam infeksi virus, bakteri, dan jamur pada tanaman (Betz et al ., 2024 ; Yang et al ., 2014 ). Selain itu, AtRALF1 mendorong fosforilasi eIF4E1 yang dimediasi AtFER, faktor inisiasi translasi eukariotik yang memainkan peran penting dalam pengendalian laju translasi mRNA, sehingga meningkatkan afinitas mRNA dan sintesis protein (Zhu et al ., 2020) .). Perlu dicatat bahwa eIF4E1 dapat melindungi mesin translasi selama infeksi virus mosaik lobak (TuMV) dan membatasi akumulasi virus di Arabidopsis (Zafirov et al ., 2023 ). Temuan ini menunjukkan bahwa modul FER-RALF memainkan peran kompleks dalam mengatur kekebalan tanaman dan infeksi mikroba.
Selain itu, beberapa mikroba tanaman mengeluarkan peptida mirip RALF yang mengikat FER inang, sehingga memudahkan infeksinya. Patogen jamur, seperti Fusarium oxysporum dan nematoda simpul akar Meloidogyne incognita , mengeluarkan peptida yang meniru RALF tanaman dan menekan kekebalan inang (Masachis et al ., 2016 ; Thynne et al ., 2017 ; Zhang et al ., 2020 ). Selain itu, faktor transkripsi F. graminearum FgPacC mengaktifkan ekspresi FgRALF, yang mengikat FER gandum, sehingga menekan kekebalan tanaman dan mendorong infeksi jamur (Wang et al ., 2024a ).
Sementara peran modul RALF-FER dalam infeksi virus tanaman sebagian besar masih belum dieksplorasi, fungsi peptida kecil yang disekresikan dalam respons pertahanan tanaman terhadap virus semakin diakui. Misalnya, gen PIP1 kentang ( Solanum tuberosum ) , yang diprediksi mengkode anggota famili peptida yang diinduksi pola molekuler terkait patogen (PAMP), memicu respons pertahanan tanaman dan memberikan resistensi terhadap infeksi virus kentang Y (Combest et al ., 2021 ). Selain itu, peptida kecil yang diinduksi virus VISP1 bertindak sebagai reseptor autofagi selektif, yang menargetkan komponen RNA silencing antivirus dan viral suppressors of RNA silencing (VSR), sehingga meningkatkan imunitas antivirus (Tong et al ., 2021 , 2023 ). Peptida kecil tanaman CLAVATA3/ESR-RELATED 7 (CLE7) dapat mengaktifkan resistensi penyakit spektrum luas terhadap berbagai infeksi virus RNA di Nicotiana benthamiana (Liu et al ., 2024 ). Untuk bertahan hidup dalam “perlombaan senjata” yang sedang berlangsung dengan tanaman inangnya, virus tanaman sering kali membajak mesin inangnya untuk melawan mekanisme pertahanan, dan mekanisme terperinci di balik interaksi ini memerlukan penyelidikan lebih lanjut.
Genus Potyvirus , yang termasuk dalam famili Potyviridae , adalah kelompok virus RNA penginfeksi tanaman terbesar yang diketahui, termasuk banyak virus penting dalam bidang pertanian seperti virus mosaik lobak (TuMV; Potyvirus rapae ) (Wu et al ., 2024a ; Yang et al ., 2021 ). TuMV menginfeksi berbagai macam tanaman budidaya dan tanaman liar, termasuk sedikitnya 318 spesies dari 156 genus dan 43 famili tanaman (Mäkinen et al ., 2023 ). Genom TuMV memiliki sekitar 10.000 nukleotida, yang mengkode 11 protein fungsional. Di antara ini, protein 6-kDa kedua, 6K2, adalah protein membran integral yang memainkan peran penting dalam merombak retikulum endoplasma untuk pembentukan vesikel replikasi virus (Wei et al ., 2010 ; Wu et al ., 2024b ). Selain itu, 6K2 dilaporkan memasuki apoplas dan memfasilitasi pergerakan virus jarak jauh (Movahed et al ., 2019 ). Khususnya, 6K2 adalah satu-satunya protein TuMV yang memicu respons protein yang tidak terlipat, sehingga memfasilitasi infeksi TuMV (Zhang et al ., 2015 ).
N. benthamiana merupakan inang percobaan dan model yang disukai karena rentan terhadap spektrum virus tanaman yang luas (Goodin et al ., 2008 ). Di sini, kami mengeksplorasi peran modul RALF-FER dalam infeksi virus tanaman dan menggunakan TuMV- N. benthamiana sebagai sistem model. Kami memilih untuk mempelajari dua RALF N. benthamiana (NbRALF1 dan NbRALF23), homolog dari dua RALF Arabidopsis yang telah dipelajari dengan baik. Kami memberikan bukti bahwa NbRALF1, tetapi bukan NbRALF23, berpartisipasi dalam infeksi TuMV. NbRALF1 bekerja sama dengan NbFER untuk memicu respons imun inang yang kuat dan memerangi infeksi TuMV, dan proses ini bergantung pada proses intraseluler. Kami selanjutnya menemukan bahwa protein TuMV 6K2 secara langsung menargetkan NbRALF1 dan mendegradasinya melalui jalur proteasom 26S untuk melawan pertahanan inang yang dimediasi modul NbRALF1-NbFER. Temuan ini memperluas pemahaman kita tentang kaskade pensinyalan RALF-FER dari tanaman solanaceous dalam memodulasi kekebalan tanaman, dan menyoroti perlombaan senjata yang sedang berlangsung antara virus dan hormon peptida tanaman.
Hasil
NbRALF1 secara negatif mengatur infeksi TuMV
Bahasa Indonesia: Kami pertama-tama menyelidiki peran NbRALF1 dan NbRALF23 pada infeksi TuMV dengan mengekspresikan sementara masing-masing dari mereka dengan klon infeksius TuMV rekombinan, TuMV-GFP, pada daun N. benthamiana . Fragmen gen GUS (β-glukuronidase) sepanjang 600 bp, yang disebut sebagai GUS 600 , digunakan sebagai kontrol. Seperti yang ditunjukkan pada Gambar S1 , pengobatan dengan NbRALF1-myc melemahkan intensitas fluoresensi GFP yang dihasilkan dari infeksi TuMV-GFP dibandingkan dengan kontrol (Gambar S1a ). Analisis lebih lanjut menggunakan Western blotting dan RT-qPCR mengungkapkan bahwa baik protein lapisan virus maupun akumulasi RNA berkurang ketika NbRALF1 diekspresikan secara berlebihan (Gambar S1b, c ). NbRALF1-myc dengan panjang penuh dan bentuk matang dari ukuran protein yang diprediksi juga terdeteksi (Gambar S1b ). Sebaliknya, NbRALF23 tidak memiliki efek pada infeksi TuMV (Gambar S1d–f ). Oleh karena itu, kami berfokus pada NbRALF1 untuk penelitian selanjutnya.
Bahasa Indonesia: Setelah infeksi TuMV, ekspresi NbRALF1 terus diinduksi dari 3 hingga 7 hari pasca inokulasi gosok dibandingkan dengan kontrol tiruan (Gambar S2 ). Kami kemudian menggunakan pendekatan interferensi RNA yang dimediasi RNA jepit rambut yang disambung intron untuk menurunkan ekspresi NbRALF1 pada tanaman inang. Konstruksi RNA silencing buatan yang mengandung sebagian RNA jepit rambut GUS (hpGUS) atau RNA jepit rambut NbRALF1 (hpNbRALF1) diekspresikan di berbagai daerah pada daun N. benthamiana yang sama bersama dengan TuMV-GFP. Daerah yang diobati dengan hpNbRALF1 menunjukkan fluoresensi GFP yang substansial dibandingkan dengan yang diobati dengan hpGUS pada 3 dpai. Analisis western blot dan RT-qPCR mengonfirmasi pengamatan ini (Gambar S3a–c ). Data RT-qPCR mengindikasikan bahwa ekspresi NbRALF1 di daerah yang diobati dengan hpNbRALF1 berkurang hingga sekitar 40% dari yang ada di hpGUS kontrol (Gambar S3c ). Selain itu, pembungkaman sistematis NbRALF1 menggunakan virus rattle tembakau menunjukkan cacat perkembangan (Gambar S4 ), dan terdapat peningkatan akumulasi TuMV pada tanaman yang dibungkam NbRALF1 dibandingkan dengan kontrol (Gambar S5a–c ).
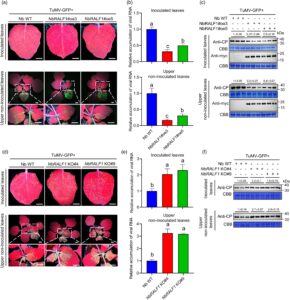
Bahasa Indonesia: Untuk lebih jauh mengonfirmasi peran NbRALF1 dalam infeksi TuMV, kami menghasilkan galur transgenik yang mengekspresikan konstruksi fusi NbRALF1-myc secara berlebihan di bawah kendali promotor 35S virus mosaik kembang kol (CaMV). Dua galur T2 independen dari NbRALF1 (NbRALF1oe#3 dan NbRALF1oe#5) dengan kadar protein fusi dan transkrip yang relatif lebih tinggi dipilih untuk analisis lebih lanjut (Gambar S6a–c ). Kedua galur NbRALF1oe ini lebih kecil daripada tanaman tipe liar (WT) (Gambar S6a ). Setelah inokulasi gosok dengan TuMV, hasil Western blot dan RT-qPCR mengungkapkan bahwa infeksi TuMV secara konsisten ditekan pada daun NbRALF1oe bagian atas yang diinokulasi dan tidak terinfeksi dibandingkan dengan tanaman WT (Gambar 1a–c ). Dua galur N. benthamiana NbRALF1 -knockout (KO) (NbRALF1 KO#4 dan NbRALF1 KO#9) juga dihasilkan menggunakan teknologi berbasis CRISPR-Cas9. Hasil sekuensing DNA menunjukkan bahwa setiap galur memiliki satu nukleotida yang disisipkan pada situs pembelahan (Gambar S7a ). Tanaman NbRALF1 KO menunjukkan fenotipe pertumbuhan yang relatif lebih lambat daripada tanaman WT (Gambar S7b ). Konsisten dengan pengamatan sebelumnya, uji infeksi TuMV pada tanaman ini menunjukkan peningkatan intensitas fluoresensi GFP dan tingkat akumulasi virus dibandingkan dengan tanaman WT (Gambar 1d–f ). Selain itu, uji infeksi dengan pepper mild mottle virus (PMMoV; Tobamovirus capsici , famili Vigaviridae ) dan potato virus X (PVX; Potexvirus ecspotati , famili Alphaflexiviridae ) pada tanaman ini menghasilkan hasil yang sebanding dengan yang diperoleh dengan TuMV (Gambar S8 dan S9 ). Secara keseluruhan, hasil ini menunjukkan bahwa NbRALF1 secara negatif mengatur beberapa infeksi virus. Agar lebih mudah, kami memilih TuMV sebagai model untuk penelitian lebih lanjut.
NbRALF1 mengaktifkan ekspresi berbagai gen respons imun
Bahasa Indonesia: Untuk menjelaskan mekanisme yang NbRALF1 berikan resistensi terhadap infeksi TuMV, kami melakukan profil transkriptom pada dua galur NbRALF1oe, galur NbRALF1 KO dan bibit N. benthamiana WT dalam kondisi infeksi TuMV atau perlakuan tiruan. Data RNA-seq dari semua sampel dikategorikan ke dalam empat klaster berbeda melalui analisis komponen utama (PCA) yang digabungkan dengan pengelompokan k-means. Komponen utama pertama (PC1) mencakup 74,18% varians, yang sebagian besar berkorelasi dengan perlakuan TuMV. PC2 menangkap 11,32% varians dan sebagian besar terkait dengan ekspresi berlebih atau knockout NbRALF1 (Gambar 2a ). Kami kemudian menggunakan algoritma pengelompokan untuk membedakan hubungan antara berbagai genotipe dan perlakuan dengan memeriksa ekspresi gen yang diekspresikan secara diferensial (DEG) terpilih. Seperti yang ditunjukkan pada Gambar 2b , sampel dipisahkan menjadi empat klaster primer berdasarkan perubahan lipatan DEG yang dipilih, dengan klaster 1 dan klaster 2 atau klaster 3 dan klaster 4 terutama dibedakan oleh perlakuan TuMV, dan di dalam setiap klaster terutama dibedakan oleh ekspresi berlebih NbRALF1 atau penghapusan NbRALF1 . Kami kemudian menganalisis lebih lanjut data sekuensing RNA untuk memahami perubahan transkripsi yang disebabkan oleh ekspresi berlebih NbRALF1 dan infeksi TuMV. Sebanyak 1840 DEG unik diidentifikasi dalam perbandingan OEV/WV (NbRALF1oe N. benthamiana yang diobati dengan TuMV vs. N. benthamiana WT yang diobati dengan TuMV ) relatif terhadap perbandingan OEM/WM (NbRALF1oe N. benthamiana yang diobati dengan tiruan vs. N. benthamiana WT yang diobati dengan tiruan ). Selain itu, 198 DEG unik diidentifikasi dalam perbandingan KOV/WV (TuMV-treated NbRALF1 KO N. benthamiana vs. TuMV-treated WT N. benthamiana ) relatif terhadap perbandingan KOM/WM (Gambar 2c ). Analisis jalur KEGG dari DEG unik ini mengungkapkan bahwa mayoritas DEG yang meningkat dalam perbandingan OEV/WV terlibat dalam transduksi sinyal hormon tanaman, interaksi tanaman-patogen, pemrosesan protein dalam retikulum endoplasma, dan jalur pensinyalan mitogen-activated protein kinase (MAPK) (Gambar 2d ). Demikian pula, mayoritas DEG yang menurun dalam perbandingan KOV/WV juga terlibat dalam jalur ini (Gambar 2e ). Kami selanjutnya memeriksa ekspresi DEG dalam istilah ‘Transduksi sinyal hormon tanaman’, ‘Interaksi tanaman-patogen’, dan ‘jalur pensinyalan MAPK’. Gen biosintesis JA JAR1 , gen metabolisme SA NPR1 , TGA , dan PR-1, dan gen-gen terkait imunitas tanaman FLS2 , MKS1 , MKK4/5 dan PR1 secara signifikan meningkat pada kelompok OEV dan secara signifikan menurun pada kelompok KOV, dibandingkan dengan WV (Gambar 2f ). RT-qPCR mengonfirmasi bahwa setelah infeksi TuMV, ekspresi gen-gen ini meningkat pada NbRALF1oe N. benthamiana tetapi menurun pada NbRALF1 KO N. benthamiana (Gambar 2g ). Secara kolektif, temuan-temuan ini menunjukkan bahwa NbRALF1 mengaktifkan berbagai jalur pertahanan inang, sehingga meningkatkan ketahanan tanaman terhadap TuMV.

Resistensi yang dimediasi NbRALF1 bergantung pada seluruh urutan RALF, bukan domain RALF1 yang matang
NbRALF1 diprediksi memiliki urutan peptida sinyal (1–26 aa) pada N-terminusnya dan domain RALF matang (68–117 aa) pada C-terminusnya, yang mencakup empat residu sistein yang terkonservasi (85, 95, 108, 114 aa). Selain itu, NbRALF1 menampilkan motif RRIL (64–67 aa) dan YISY (72–75 aa) yang terkonservasi (Gambar 3a ). Untuk menentukan kontribusi motif-motif ini terhadap resistensi yang dimediasi RALF1 terhadap infeksi TuMV, kami membuat serangkaian mutan NbRALF1. Ini termasuk: NbRALF1 1-63 dan NbRALF1 68-117 , yang merupakan fragmen terpotong yang diharapkan dihasilkan dari pembelahan di situs RRIL; NbRALF1 AAIL , tempat situs pembelahan S1P RRIL dimutasi menjadi AAIL; NbRALF1 AIAY , tempat motif pengikatan YISY pada RALF1 matang, yang dikenali oleh FER, dimutasi menjadi AIAY; dan NbRALF1 C85A,C108A , tempat residu sistein pertama dan ketiga digantikan dengan alanin (Gambar 3b dan S10a ). Setiap mutan dan RALF1 tipe liar diekspresikan bersama dengan TuMV-GFP di berbagai petak daun N. benthamiana yang sama untuk menilai hilangnya resistensi terhadap infeksi TuMV. Seperti yang ditunjukkan pada Gambar S10b , baik NbRALF1 1-63 -myc maupun NbRALF1 68-117 -myc menunjukkan intensitas fluoresensi GFP yang lebih tinggi dibandingkan dengan NbRALF1-myc normal. Ini menunjukkan bahwa resistensi yang dimediasi NbRALF1 tidak bergantung pada RALF1 dewasa (NbRALF1 68-117 -myc) tetapi pada seluruh RALF1. Selain itu, mutan NbRALF1 C85A,C108A menunjukkan fenotipe yang mirip dengan kedua mutan ini, yang menunjukkan peran penting residu sistein dalam resistensi yang dimediasi NbRALF1. Konsisten dengan pengamatan di atas, mutan yang menghapuskan produksi RALF1 dewasa (NbRALF1 AAIL ) atau mengganggu pengenalan FER pada RALF1 dewasa (NbRALF1 AIAY ) menunjukkan intensitas fluoresensi yang mirip dengan RALF1-myc tipe liar, yang menunjukkan bahwa fungsi-fungsi ini mungkin tidak terlibat dalam resistensi yang dimediasi NbRALF1 (Gambar 3b ). Kontrol GUS 600 -myc secara konsisten menunjukkan peningkatan fluoresensi GFP yang berasal dari virus dibandingkan dengan NbRALF1-myc. Analisis western blotting dan RT-qPCR mengonfirmasi pengamatan ini (Gambar 3d,e ; Gambar S10c,d ). Secara kolektif, hasil ini menunjukkan bahwa resistensi yang dimediasi RALF1 bergantung pada seluruh urutan RALF1, khususnya residu sistein yang terkonservasi, bukan domain RALF1 matang yang dilaporkan sebelumnya.
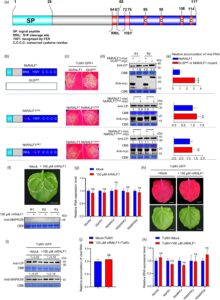
Bahasa Indonesia: Untuk lebih memperjelas peran RALF1 matang dalam aktivasi imunitas dan infeksi TuMV pada N. benthamiana , kami memperlakukan daun tanaman dengan peptida RALF1 matang yang disintesis secara in vitro (mRALF1) melalui aplikasi semprotan. Kami memantau aktivasi jalur MAPK3/6, indikator utama imunitas tanaman, menggunakan antibodi MAPK3/6 spesifik fosforilasi. Analisis Western blot tidak mengungkapkan sinyal MAPK3/6 yang terdeteksi baik dalam sampel yang diobati dengan mRALF1 maupun yang diobati dengan tiruan. Demikian pula, RT-qPCR tidak menunjukkan perbedaan signifikan dalam ekspresi gen terkait imun antara perlakuan ini (Gambar 3f,g ). Kami kemudian menginokulasi daun yang diobati dengan TuMV-GFP dengan menggosokkan virus ke permukaan daun. Seperti yang ditunjukkan pada Gambar 3h–J , perlakuan mRALF1 tidak memengaruhi tingkat infeksi TuMV dibandingkan dengan perlakuan tiruan. Khususnya, infeksi TuMV secara kuat mengaktifkan jalur MAPK di kedua kelompok perlakuan, menghasilkan sinyal MAPK3/6 yang sebanding (Gambar 3i ). RT-qPCR selanjutnya menegaskan bahwa ekspresi gen terkait imunitas tetap tidak berubah antara pengobatan mRALF1 dan pengobatan tiruan (Gambar 3k ). Secara kolektif, hasil ini menunjukkan bahwa resistensi yang dimediasi RALF1 pada N. benthamiana tidak bergantung pada domain RALF1 yang matang.
NbRALF1 bergantung pada NbFER untuk memicu kekebalan inang dan menekan infeksi TuMV
Berikutnya, kami berusaha menyelidiki keterlibatan NbFER dalam mengaktifkan imunitas dan resistensi yang dimediasi RALF1 terhadap infeksi TuMV. Uji ko-imunopresipitasi menunjukkan bahwa NbFER memang dapat berinteraksi dengan NbRALF1 (Gambar S11 ). Ko-ekspresi NbFER meningkatkan resistensi yang dimediasi NbRALF1 terhadap infeksi TuMV (Gambar S12a–c ). Efek ini ditemukan bergantung pada aktivitas kinase NbFER, karena ko-ekspresi mutan NbFER K560R yang tidak aktif terhadap kinase dengan NbRALF1 mengakibatkan peningkatan infeksi TuMV-GFP (Gambar S13 dan S12d–f ). Dalam protoplas N. benthamiana , ko-ekspresi NbFER dan NbRALF1 secara signifikan mengurangi akumulasi RNA virus dibandingkan dengan pengobatan NbRALF1 dan GUS 600 (Gambar S14a ). Demikian pula, ekspresi NbFER yang diinduksi estradiol (melalui XVE-NbFER) dalam protoplas NbRALF1oe menekan akumulasi RNA virus dibandingkan dengan sampel yang diberi perlakuan semu (Gambar S14b ). Uji indikator terkait imunitas menunjukkan bahwa ekspresi NbFER yang diinduksi estradiol dalam tanaman NbRALF1oe meningkatkan akumulasi MAPK3/6 dan meningkatkan gen terkait imunitas (Gambar 4a–c ). Uji infeksi TuMV lebih lanjut mengungkapkan bahwa ekspresi NbFER yang diinduksi estradiol mengurangi infeksi TuMV-GFP dan meningkatkan imunitas tanaman pada tanaman NbRALF1oe (Gambar 4d–f ). Khususnya, pada daun yang dibungkam NbFER , perlakuan NbRALF1-myc kehilangan resistensinya terhadap infeksi TuMV, menunjukkan akumulasi virus yang serupa dengan perlakuan GUS 600 -myc (Gambar 4g–i ). Secara kolektif, temuan ini menunjukkan bahwa NbRALF1 membutuhkan aktivitas kinase NbFER untuk memberikan resistensi terhadap infeksi TuMV.
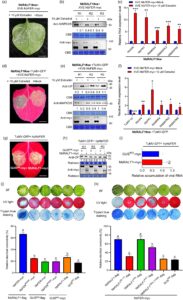
Sementara ekspresi NbRALF1 dapat memicu fenotipe kematian sel yang relatif lemah, ko-ekspresi NbFER dengan NbRALF1 menginduksi kematian sel yang jauh lebih kuat pada daun N. benthamiana , bahkan tanpa adanya infeksi TuMV (Gambar 4j ). Hal ini dapat diamati di bawah sinar biasa dan UV dan selanjutnya dikonfirmasi melalui pewarnaan biru trypan dan uji kebocoran ion (Gambar 4j ). Ekspresi NbFER dengan kontrol tidak menghasilkan fenotipe ini. Ko-ekspresi NbRALF1 dengan mutan NbFER K560R yang tidak aktif kinase tidak memicu kematian sel. Akumulasi protein untuk setiap perlakuan dikonfirmasi oleh analisis Western blot (Gambar S15a ). Hasil-hasil ini menunjukkan bahwa NbRALF1 bekerja sama dengan NbFER dan aktivitas kinasenya untuk memicu respons imun inang yang kuat.
Bahasa Indonesia: Untuk lebih jauh mengeksplorasi bagaimana modul NbRALF1-NbFER mengaktifkan imunitas inang, kami menyelidiki efek mutan NbRALF1 seperti yang dijelaskan sebelumnya. NbRALF1 tipe liar, setiap mutan NbRALF1, dan kontrol GUS 600 diekspresikan bersama dengan NbFER pada daun N. benthamiana , dan fenotipe kematian sel dinilai pada 3 dpai. Seperti yang ditunjukkan pada Gambar 4k , ketika diekspresikan bersama dengan NbFER, mutan NbRALF1 AAIL menunjukkan fenotipe kematian sel yang mirip dengan NbRALF1 tipe liar, yang menunjukkan bahwa aktivasi imunitas inang ini tidak bergantung pada pematangan NbRALF1. Secara konsisten, NbRALF1 68-117 yang matang tidak dapat bekerja sama dengan NbFER untuk memicu kematian sel. Selain itu, ketika motif pengenalan ekstraseluler YISY, yang dikenali oleh NbFER, bermutasi, pengobatan NbRALF1 AIAY dengan NbFER masih memicu kematian sel, meskipun fenotipenya sedikit lebih ringan dibandingkan dengan RALF1 tipe liar, yang selanjutnya mendukung gagasan bahwa aktivasi imunitas inang yang dimediasi modul NbRALF1-NbFER sebagian besar tidak bergantung pada reaksi ekstraseluler. Akhirnya, mutan NbRALF1 C85A,C108A tidak dapat bekerja sama dengan NbFER untuk memicu kematian sel. Akumulasi protein untuk setiap pengobatan dikonfirmasi oleh analisis Western blot (Gambar S15b ). Ketika kami secara individual mengekspresikan NbRALF1 tipe liar, masing-masing mutannya, dan kontrol GUS 600 pada daun N. benthamiana , tidak satu pun dari konstruksi ini yang menginduksi kematian sel, kecuali NbRALF1 tipe liar, yang menghasilkan fenotipe kematian sel yang relatif lemah (Gambar S16 ). Secara keseluruhan, hasil ini menyiratkan bahwa sementara NbRALF1 bergantung pada NbFER hilir untuk mengaktifkan kekebalan inang, seluruh RALF1 dan residu sistein yang dilestarikannya sangat penting dalam proses ini.
Kaskade RALF1-FER intraseluler berkontribusi pada aktivasi kekebalan host
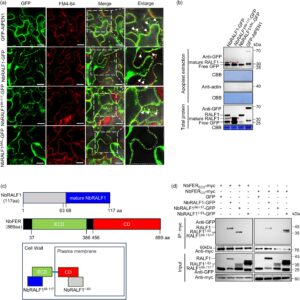
Dalam Arabidopsis, peptida RALF dewasa mengikat ECD dari FER, sehingga mengaktifkan aktivitas kinase FER dan kaskade pensinyalan hilir berikutnya (Stegmann et al ., 2017 ; Zhang et al ., 2020 ). Mengingat pengamatan kami bahwa ketika diekspresikan dengan NbFER, NbRALF1 68-117 dewasa tidak memicu kematian sel dan bahwa mutan NbRALF1 AAIL , yang mengekspresikan seluruh urutan RALF1 tetapi tidak dapat disekresikan ke apoplas (karena mutasi mencegah pematangan) masih menimbulkan fenotipe kematian sel yang mirip dengan RALF1 tipe liar, kami berhipotesis bahwa NbRALF1 dapat berfungsi secara intraseluler dengan NbFER untuk mengaktifkan imunitas inang. Untuk menguji hipotesis ini, pertama-tama kami memeriksa lokalisasi subseluler dari mutan ini. Protein pelokalisasi apoplas yang berkarakterisasi baik AtPEN1 digunakan sebagai kontrol positif (Movahed et al ., 2019 ). NbRALF1 tipe liar, bentuk dewasanya NbRALF1 68-117 , dan mutan NbRALF1 AAIL masing-masing digabungkan dengan GFP di C-terminus dan diekspresikan sementara di daun N. benthamiana . Seperti yang ditunjukkan pada Gambar 5a , fluoresensi GFP-AtPEN1 diamati antara membran plasma yang diwarnai dengan FM4-64 setelah plasmolisis, yang menunjukkan lokalisasi apoplas. Baik NbRALF1-GFP dan NbRALF1 68-117 -GFP terlihat jelas di apoplas, sedangkan mutan NbRALF1 AAIL tidak memasuki apoplas, yang mengonfirmasi lokalisasi intraselulernya. Kami juga mengekstraksi komponen apoplas dan memvalidasi temuan ini dengan analisis imunoblotting (Gambar 5b ). Sementara itu, kami menemukan bahwa infeksi TuMV tidak mempengaruhi lokalisasi NbRALF1 dan mutannya (Gambar S17 ). Akhirnya, uji BiFC dan ko-imunopresipitasi (Co-IP) memberikan bukti tambahan bahwa ECD NbFER ekstraseluler memang mengikat NbRALF1 matang (residu 68–117), sementara CD NbFER intraseluler ditemukan berinteraksi dengan NbRALF1 N-terminal (residu 1–63) (Gambar S18 ; Gambar 5c,d ). Secara kolektif, temuan ini memberikan dukungan lebih lanjut untuk gagasan bahwa kapasitas NbRALF1 untuk mengaktifkan imunitas inang mungkin tidak memerlukan sekresinya ke apoplas; sebaliknya, itu dapat melibatkan interaksi intraseluler dengan NbFER di N. benthamiana .
TuMV 6K2 dan VPg berinteraksi dengan NbRALF1
Mengingat bahwa TuMV masih dapat membangun infeksi yang berhasil dengan adanya NbRALF1 dan NbFER yang diekspresikan bersamaan, tanpa menunjukkan fenotipe kematian sel yang jelas (Gambar 4d ), kami berhipotesis bahwa TuMV dapat mengodekan efektor yang menetralkan resistensi yang diberikan oleh modul NbRALF1–NbFER. Karena NbRALF1 berfungsi di hulu NbFER, kami berfokus pada kemungkinan interaksi protein-protein antara NbRALF1 dan masing-masing protein TuMV. Analisis ragi dua-hibrida (Y2H) menunjukkan potensi interaksi antara NbRALF1 dan beberapa protein TuMV, termasuk VPg, P3, NIb, dan 6K2 (Gambar 6a ). Dalam uji BiFC berikutnya, terdapat sinyal fluoresensi YFP yang direkonstitusi kuat yang menunjukkan interaksi positif antara NbRALF1 dan protein TuMV 6K2 dan VPg, tetapi bukan protein virus lainnya (Gambar 6b ; Gambar S19 ). Kontrol negatif tidak menunjukkan sinyal fluoresensi. 6K2 berinteraksi dengan NbRALF1 terutama di sitoplasma dan kloroplas, sedangkan interaksi antara VPg dan NbRALF1 tampaknya terlokalisasi pada nukleus (Gambar 6b ). Uji pencitraan komplementasi luciferase (LCI) selanjutnya memvalidasi interaksi antara NbRALF1 dan 6K2 dan VPg (Gambar 6c ). Akhirnya, uji Co-IP memberikan bukti tambahan bahwa NbRALF1 dapat berinteraksi dengan 6K2 dan VPg (Gambar 6d ). Secara keseluruhan, temuan kami menyimpulkan bahwa TuMV 6K2 dan VPg dapat berinteraksi langsung dengan NbRALF1.
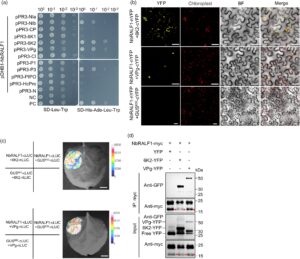
TuMV 6K2 mendegradasi NbRALF1 untuk melawan kekebalan inang
Bahasa Indonesia: Dalam uji Co-IP kami, kami mengamati penurunan yang nyata dalam akumulasi NbRALF1-myc ketika diekspresikan bersama dengan 6K2-YFP, tetapi tidak dengan VPg-YFP atau kontrol YFP, dalam sampel input (Gambar 6d ). Untuk mengonfirmasi pengamatan ini lebih lanjut, kami mengekspresikan NbRALF1 dan YFP secara bersamaan, 6K2-YFP atau VPg-YFP di beberapa petak daun yang sama pada tanaman N. benthamiana . Hasil western blotting dengan jelas menunjukkan bahwa akumulasi NbRALF1-myc berkurang hingga 60%–80% pada perlakuan 6K2-YFP dibandingkan dengan kontrol YFP (Gambar 7a ). Sebaliknya, perlakuan VPg-YFP tidak memengaruhi akumulasi NbRALF1-myc (Gambar S20 ). Kami juga mengekspresikan YFP dan 6K2-YFP secara sementara di petak-petak berbeda dari daun yang sama pada tanaman NbRALF1oe#3, dan akumulasi NbRALF1-myc secara konsisten berkurang di bawah perlakuan 6K2-YFP (Gambar 7a ). Kami selanjutnya meneliti fenomena ini dalam konteks infeksi TuMV. Mutasi TuMV-ΔGDD yang replikasinya cacat berfungsi sebagai kontrol negatif. Sementara akumulasi GUS 600 -myc tetap tidak terpengaruh di bawah infeksi TuMV, kadar NbRALF1-myc menurun dibandingkan dengan yang di bawah perlakuan TuMV-ΔGDD (Gambar 7b ). Akumulasi protein lapisan minimal yang diamati dalam sampel yang diobati dengan TuMV-ΔGDD dikaitkan dengan aktivitas promotor 35S (Gambar 7b ). Untuk menguji hubungan sebaliknya, kami mengekspresikan 6K2-YFP secara sementara bersama dengan NbRALF1-myc atau GUS 600 -myc di petak-petak berbeda dari daun N. benthamiana yang sama . Analisis western blot mengungkapkan bahwa tingkat akumulasi 6K2-YFP tetap tidak berubah pada pengobatan NbRALF1-myc dibandingkan dengan pengobatan kontrol GUS 600 -myc (Gambar S20 ).
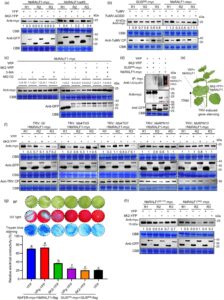
Untuk mengeksplorasi mekanisme potensial yang mendasari degradasi NbRALF1 yang dimediasi 6K2, kami memperlakukan sampel dengan carbobenzoxy-L-leucyl-L-leucyl-L-leucinal (MG132), yang menghambat proteasom 26S, atau 3-metiladenina (3-MA), yang menghambat autofagi, atau keduanya. Hasil kami menunjukkan bahwa MG132 atau keduanya, tetapi bukan 3-MA saja, dapat meringankan degradasi NbRALF1 yang dimediasi 6K2, menghasilkan tingkat akumulasi yang sebanding dengan yang diamati dalam perlakuan kontrol YFP (Gambar 7c ). Temuan ini menunjukkan bahwa pergantian NbRALF1 terutama bergantung pada jalur ubiquitin (Ub)-proteasome. Untuk memastikan apakah NbRALF1 ditargetkan untuk degradasi oleh jalur proteasom 26S, kami melakukan percobaan co-IP untuk mendeteksi keberadaan Ub endogen dalam kompleks protein NbRALF1-6K2. Seperti yang ditunjukkan pada Gambar 7d , sejumlah besar Ub dideteksi dengan antibodi spesifik Ub dalam sampel yang mengekspresikan NbRALF1-myc dan 6K2-YFP. Sebaliknya, sedikit atau tidak ada Ub yang dideteksi dalam perlakuan kontrol.
Akhirnya, kami menggunakan sistem pembungkaman gen yang diinduksi virus berbasis TRV untuk membungkam gen jalur autofagi ( NbATG5 atau NbATG7 ) atau proteasom 26S ( NbRPN10 atau NbRPN13 ) utama (Ji et al ., 2021 ) (Gambar 7e ; Gambar S22 ), dan kemudian menyelidiki efeknya pada akumulasi NbRALF1. Sementara 6K2-YFP dengan mudah mengurangi akumulasi NbRALF1-myc dibandingkan dengan kontrol YFP di bawah perlakuan TRV:00, pembungkaman NbRPN10 atau NbRPN13 secara substansial meringankan degradasi NbRALF1 yang dimediasi 6K2. Pembungkaman dua gen jalur autofagi tidak mencegah degradasi NbRALF1 yang dimediasi 6K2 (Gambar 7f ). Secara keseluruhan, hasil ini memberikan bukti kuat bahwa 6K2 menargetkan NbRALF1 untuk degradasi melalui jalur proteasom 26S.
Selanjutnya, kami menyelidiki efek 6K2 dan VPg pada kematian sel yang diinduksi oleh modul RALF1-FER pada sel inang. Seperti yang ditunjukkan pada Gambar 7g , pengobatan dengan 6K2 secara signifikan mengurangi kematian sel yang dipicu oleh ko-ekspresi NbFER dan NbRALF1. Sebaliknya, VPg tidak memiliki efek yang dapat diamati. Fenomena ini terbukti di bawah cahaya biasa dan UV dan selanjutnya divalidasi melalui pewarnaan biru trypan dan uji kebocoran ion. Analisis western blotting mengonfirmasi akumulasi protein untuk setiap pengobatan (Gambar S23 ). Akhirnya, karena TuMV 6K2 juga dapat menargetkan apoplas (Movahed et al ., 2019 ), kami menentukan apakah 6K2 menargetkan NbRALF1 untuk degradasi di dalam sel atau di ruang ekstraseluler. Untuk tujuan ini, mutan NbRALF1 AAIL atau bentuk matang NbRALF1 (NbRALF1 68-117 ) diekspresikan bersama dengan 6K2-YFP atau YFP pada daun N. benthamiana . Kami sebelumnya telah menunjukkan bahwa NbRALF1 68-117 -GFP terlihat jelas dalam apoplas, sedangkan mutan NbRALF1 AAIL tidak memasuki apoplas (Gambar 5 ). Di sini, hasil Western blotting mengungkapkan bahwa ketika diekspresikan bersama dengan 6K2-YFP, kadar NbRALF1 AAIL -myc menurun secara signifikan dibandingkan dengan kontrol YFP, sedangkan kadar NbRALF1 68-117 -myc matang tetap tidak terpengaruh (Gambar 7h ). Secara keseluruhan, temuan ini menunjukkan bahwa TuMV 6K2 menargetkan NbRALF1 untuk degradasi intraseluler, sehingga melawan aktivasi imunitas inang yang dimediasi oleh modul NbRALF1-NbFER.
Diskusi
Keluarga peptida RALF, yang awalnya diidentifikasi oleh kemampuan untuk menyebabkan alkalinisasi cepat media ekstraseluler tembakau ( N. tabacum ) dan untuk mengaktifkan jalur MAPK (Pearce et al ., 2001 ), sejak itu telah terlibat dalam imunitas tanaman. Namun, pemahaman kita tentang peran dan mekanismenya dalam konteks ini masih belum lengkap. Sementara RALF adalah superfamili yang tersebar luas pada tanaman, bukti eksperimental untuk keterlibatan mereka dalam imunitas tanaman telah terbatas pada beberapa anggota, seperti RALF17, RALF23, dan RALF33, yang telah terbukti berperan melawan patogen hemibiotropik (Merino et al ., 2019 ; Stegmann et al ., 2017 ). Belum jelas apakah RALF memiliki peran dalam infeksi virus tanaman. Dalam studi ini, kami memberikan bukti pertama bahwa NbRALF1 dapat mengatur infeksi virus secara negatif (Gambar 1 ), mengungkap aspek baru keterlibatan RALF dalam interaksi tanaman-virus.
Sebagian besar peptida RALF dewasa pada tanaman memiliki domain yang dilestarikan, termasuk motif YISY di ujung N dan empat residu sistein di dekat ujung C (Campbell dan Turner, 2017 ). Dalam Arabidopsis, motif YISY dari peptida RALF dewasa diketahui mengikat ECD FER, yang memulai jalur kinase FER (Haruta et al ., 2014 ; Stegmann et al ., 2017 ; Zhang et al ., 2020 ). Hasil kami menunjukkan bahwa NbRALF1 dapat menginduksi imunitas basal tanaman dan menekan infeksi TuMV. Namun, kemampuan ini tidak bergantung pada motif RRIL dan YISY yang dilestarikan dari NbRALF1 (Gambar 3 ). Hanya mempertahankan peptida matang (68–117 aa) atau peptida sinyal (1–63 aa) dari NbRALF1, atau memutasi situsnya yang terkonservasi sistein, semuanya mengakibatkan hilangnya kemampuan untuk menghambat infeksi TuMV (Gambar S10 ). Aplikasi semprotan mRALF1 juga tidak menunjukkan resistensi terhadap infeksi TuMV (Gambar 3h–j ). Kemampuan NbRALF1 untuk menghambat infeksi TuMV bergantung pada NbFER dan fungsi fosforilasinya (Gambar 4 ; Gambar S12 ). Ko-infiltrasi NbRALF1 dan NbFER menginduksi respons kematian sel yang kuat yang tidak dihapuskan oleh mutasi pada motif RRIL atau YISY dari NbRALF1 (Gambar 4 ). Ini menunjukkan bahwa NbRALF1 dapat mengenali bagian intraseluler NbFER untuk menginduksi respons imun yang lebih kuat dan menekan infeksi virus, berbeda dari PTI yang diinduksi oleh pengikatan YISY-FER yang dilaporkan dalam respons terhadap jamur dan bakteri. Selain itu, dalam studi yang sangat baru, AtFER ditemukan mengalami pembelahan pada domain sitoplasmiknya setelah invasi bakteri, dan fragmen pembelahan yang dihasilkan, FERN, terakumulasi dalam nukleus dan meningkatkan respons imun pada akar, dengan demikian mempertahankan diri terhadap infeksi bakteri (Chen et al ., 2024 ). Menariknya, kami juga mendeteksi fragmen FER yang lebih kecil yang ukurannya sesuai dengan FERN setelah ko-ekspresi NbFER dan TuMV-GFP (Gambar S12b,e ). Masih harus ditentukan apakah fragmen ini merupakan respons spesifik terhadap infeksi virus dan apa perannya dalam respons imun.
Peptida RALF potensial juga telah diidentifikasi dalam genom jamur dan bakteri (Masachis et al ., 2016 ; Thynne et al ., 2017 ). Misalnya, F. oxysporum mengeluarkan peptida mirip RALF yang meniru RALF tanaman, mengaktifkan kinase FER, dan menghambat aktivitas AHA, yang menginduksi alkalinisasi apoplas dan mengaktifkan kinase MAPK FMK1 ortolog, yang mendorong virulensi pada jamur (Masachis et al ., 2016 ). Namun, genom virus tanaman, yang umumnya kecil dan mengkode protein terbatas, tampaknya tidak mengkode sekuens mirip RALF. Perbandingan kami antara sekuens genom RALF dan TuMV tidak menemukan sekuens mirip RALF di TuMV. Hal ini menimbulkan pertanyaan tentang bagaimana TuMV menahan resistensi yang diinduksi modul NbFER-NbRALF1 untuk membangun infeksi yang berhasil. Studi lebih lanjut menunjukkan bahwa protein 6K2 yang dikodekan TuMV dapat berinteraksi dengan NbRALF1 (Gambar 6 ). Menariknya, interaksi ini menghambat akumulasi NbRALF1 pada tingkat protein (Gambar 7 ). Analisis lebih lanjut mengungkapkan bahwa 6K2 dapat mendegradasi NbRALF1 melalui jalur proteasom 26S (Gambar 7 ). Hal ini menunjukkan bahwa, tidak seperti jamur dan bakteri, yang dapat mengeluarkan protein seperti RALF, virus menggunakan protein yang dikodekan sendiri untuk membajak jalur proteasom inang untuk menekan kekebalan yang diinduksi modul NbRALF1-NbFER, sehingga memfasilitasi infeksi mereka sendiri.
Studi kami juga menimbulkan beberapa pertanyaan yang memerlukan investigasi lebih lanjut. Pertama, mekanisme NbRALF1 mengenali infeksi virus dan mengirimkan sinyal imun belum jelas. Ada kemungkinan bahwa NbRALF1 dapat mengenali TuMV VPg untuk memediasi proses ini (Gambar 6 ), tetapi ini memerlukan studi lebih lanjut. Kedua, sementara motif YISY dari RALF1 dewasa diketahui mengatur respons PTI dengan mengikat domain ekstraseluler FER (Haruta et al ., 2014 ; Stegmann et al ., 2017 ; Zhang et al ., 2020 ), studi kami menunjukkan bahwa NbRALF1 dapat mengenali domain intraseluler FER untuk menginduksi respons imun yang lebih kuat. Mekanisme terperinci yang menyebabkan pengenalan ini menginduksi kematian sel masih belum jelas. Selain itu, komponen pensinyalan hilir penting yang terlibat dalam aktivasi imunitas host yang dimediasi modul NbRALF1-NbFER memerlukan investigasi lebih lanjut. Telah dilaporkan bahwa eIF4E1 diperlukan untuk mempertahankan translasi tanaman global dan membatasi akumulasi TuMV selama infeksi (Zafirov et al ., 2023 ), dan AtRALF1 dapat meningkatkan fosforilasi eIF4E1 yang dimediasi AtFER (Zhu et al ., 2020 ), jadi masuk akal untuk berasumsi bahwa eIF4E1 mungkin merupakan target utama dalam resistensi yang dimediasi NbRALF1-NbFER terhadap infeksi TuMV.
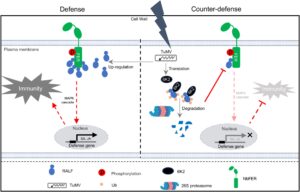
Sebagai kesimpulan, kami mengusulkan model untuk peran modul RALF1-FER dalam mengaktifkan imunitas inang dan strategi penangkalan virus tanaman (Gambar 8 ): Dengan tidak adanya infeksi TuMV, NbRALF1 kemungkinan mengenali CD intraseluler FER untuk mengaktifkan aktivitas kinasenya dan respons imun hilir berikutnya. Setelah infeksi TuMV, NbRALF1 diatur ke atas untuk meningkatkan respons imun ini dan mempertahankan diri terhadap infeksi TuMV. Untuk menangkal respons pertahanan inang ini, protein 6K2 yang dikodekan TuMV secara langsung berinteraksi dengan NbRALF1 dan meningkatkan degradasinya melalui jalur proteasom 26S, sehingga menghasilkan infeksi sistemik yang berhasil.
Bahan dan metode
Bahan tanaman dan inokulasi virus
Tanaman yang mengekspresikan konstruksi pCV-NbRALF1-myc secara stabil atau dengan knock-out gen NbRALF1 dihasilkan melalui transformasi cakram daun menggunakan N. benthamiana tipe liar sebagai garis latar belakang. Transforman disaring untuk resistensi higromisin B pada media MS. Semua tanaman N. benthamiana ditanam di rumah kaca bebas serangga pada suhu 24 ± 1 °C, dengan siklus terang/gelap 16 jam/8 jam dan kelembaban relatif 70 ± 5%, seperti yang dijelaskan sebelumnya (Rui et al ., 2022a ).
Konstruksi plasmid
Urutan pengkodean gen yang diinginkan diperkuat dari cDNA N. benthamiana menggunakan PCR dengan PrimerSTAR Max DNA Polymerase (Takara , Jepang), dan kemudian dikloning ke dalam berbagai vektor ekspresi, menggunakan metode kloning independen ligasi atau teknologi kloning Gateway. Urutan pengkodean gen TuMV diperkuat dari klon infeksius TuMV::GFP (Nomor akses GenBank: NC_002509.2). Mutagenesis terarah-situs NbRALF1 dicapai menggunakan PCR ekstensi tumpang tindih dengan pasangan primer spesifik yang tercantum dalam Tabel S1 . Vektor ekspresi biner tanaman pEarleyGate104 digunakan untuk menghasilkan konstruksi berlabel YFP N-terminal (Earley et al ., 2006 ). Vektor pCV-LIC-Myc digunakan untuk membangun konstruksi berlabel myc C-terminal. Vektor tujuan Gateway-compatible yang dapat diinduksi β-estradiol pMDC7 digunakan untuk mengekspresikan protein fusi XVE-NbFER-myc. Vektor pCV-LIC-nYFP dan pCV-LIC-cYFP digunakan untuk menghasilkan konstruksi untuk uji komplementasi fluoresensi bimolekuler (BiFC), sementara pCV-LIC-nLuc dan pCV-LIC-cLuc digunakan untuk uji split-luciferase (Fang et al ., 2024 ). Semua plasmid diverifikasi dengan sekuensing DNA.
Ekstraksi protein dan analisis western blot
Sampel tanaman dipanen dan diproses dengan menggilingnya menjadi bubuk halus menggunakan nitrogen cair. Penyangga lisis protein, terdiri dari 0,01 M Phosphate Buffered Saline (PBS) pada pH 7,5, 2% natrium sulfit (Na2SO3 ) , 0,05% NP- 40 , dan 0,1% β-merkaptoetanol, bersama dengan penyangga pemuatan SDS-PAGE, ditambahkan ke sampel bubuk dan diinkubasi dalam bak logam pada 85 °C selama 15 menit. Sampel kemudian didinginkan dengan cepat di atas es selama 5 menit sebelum disentrifugasi pada 12000 rpm selama 5 menit untuk memisahkan ekstrak protein. Pencitraan chemiluminescent dilakukan dengan menggunakan substrat Immobilon Western chemiluminescent horseradish peroxidase (HRP) (Millipore) pada mesin Amersham Imager 680 (GE), mengikuti petunjuk pabrik. Setelah deteksi chemiluminescence pada membran PVDF, pewarnaan Coomassie Brilliant Blue (CBB) digunakan untuk menilai konsistensi muatan di berbagai gel paralel.
Isolasi RNA dan PCR transkripsi balik kuantitatif (RT-qPCR)
Kit RNA tanaman EasyPure (Transgen biotech, Tiongkok) digunakan untuk mengekstraksi total RNA dari sampel tanaman, mengikuti petunjuk pabrik. Kit TransScript All-in-One (Transgen biotech, Tiongkok) digunakan untuk menghilangkan DNA genomik dan mensintesis cDNA untai pertama dari ekstrak RNA, yang digunakan untuk qPCR berikutnya. Kit campuran utama PCR SYBR Green (Vazyme, Tiongkok) digunakan untuk melakukan uji qPCR pada sistem PCR waktu nyata LightCycler 480 II (Roche, Jerman). Data eksperimen dianalisis menggunakan metode delta–delta C T untuk menentukan tingkat ekspresi gen relatif dari gen yang diinginkan. Gen aktin II dari N. benthamiana dipilih sebagai kontrol referensi internal untuk normalisasi (Wu et al ., 2022 ). Setiap eksperimen independen mencakup triplikat biologis, dengan minimal tiga replikasi teknis per sampel. Primer spesifik yang digunakan untuk qPCR dalam penelitian kami dirinci dalam Tabel S1 .
Perawatan RNA-seq
Dalam percobaan RNA-Seq in vitro , galur NbRALF1oe berumur tiga minggu (OE3 dan OE5), galur NbRALF1 KO, dan bibit N. benthamiana WT diinokulasi dengan TuMV atau 1× PBS (Mock). Daun bagian atas yang tidak diinokulasi dari sampel tanaman yang diberi perlakuan dikumpulkan 7 hari setelah infiltrasi. Ekstraksi RNA total, konstruksi pustaka cDNA, dan pengurutan dilakukan oleh Novogene (Beijing) Co., Ltd. pada Novaseq-PE150. Hasil pembacaan bersih berkualitas tinggi diperoleh setelah filtrasi, dan selanjutnya diselaraskan dengan genom referensi N. benthamiana menggunakan genom Nb HZ versi 1, tersedia di https://lifenglab.hzau.edu.cn/Nicomics (Wang et al ., 2024b ). Analisis bioinformatika dilakukan menggunakan perangkat Novomagic di https://magic-plus.novogene.com . Percobaan dilakukan dengan tiga replikasi biologis untuk setiap perlakuan.
Isolasi protoplas dan uji replikasi virus
Isolasi protoplas dilakukan seperti yang dijelaskan sebelumnya (Fang et al ., 2024 ). Secara singkat, sekitar 0,1 g jaringan daun N. benthamiana (dengan epidermis bawah dibuang) dicerna dengan 5 mL campuran enzim (mengandung 1,5% selulase R-10, 0,5% maserozim R-10, 5 mM asam 2-morfolinoetanasulfonat (MES), 0,1% bovin serum albumin, 10 mM CaCl2 , dan 0,4 M manitol, pH 5,8), dan diinkubasi pada suhu 25 °C selama 1 jam dalam gelap. Setelah pencernaan, protoplas dikumpulkan dari antarmuka manitol-MES 0,4 M dan larutan sukrosa 0,55 M dengan sentrifugasi. Protoplas yang dimurnikan kemudian diencerkan dengan tepat, dan konsentrasinya ditentukan menggunakan hemositometer di bawah mikroskop. Sekitar 1 × 105 protoplas ditransfeksi dengan plasmid yang ditunjukkan dalam 40% PEG 4000 dalam 0,8 M manitol dan 1 M CaCl2 pada suhu kamar selama 20 menit. Protoplas yang ditransformasi kemudian dicuci dan disuspensikan kembali dalam buffer W5 (154 mM NaCl, 125 mM CaCl2 , 5 mM KCl, dan 2 mM MES, pH 5,7) dan diinkubasi untuk ekspresi protein dan replikasi virus.
Uji pewarnaan biru tripan
Pewarnaan biru tripan dilakukan seperti yang dijelaskan sebelumnya (Yuan et al ., 2023 ). Larutan kerja pewarnaan biru tripan terdiri dari 10 mL asam laktat, 10 mL air suling steril, 10 mL fenol, 10 mL gliserol, dan 0,1 g biru tripan. Daun tanaman yang diberi perlakuan dipanen dengan gunting pada 3 hari setelah pewarnaan dan kemudian dicuci dua kali dengan air suling steril. Daun N. benthamiana yang telah dibersihkan kemudian dimasukkan ke dalam larutan biru tripan segar dan direbus selama 10 menit, memastikan bahwa daun terendam seluruhnya dalam cairan. Setelah larutan kerja mendingin hingga suhu ruangan, daun diinkubasi lebih lanjut dalam larutan kerja selama 2 jam dan kemudian dihilangkan warnanya dua kali dengan 2,5 g/mL kloral hidrat selama 24 jam. Warna biru kemudian menunjukkan lokasi jaringan yang mati.
Deteksi kebocoran elektrolit
Uji kebocoran elektrolit dilakukan seperti yang dijelaskan sebelumnya (Jia et al ., 2025 ). Secara singkat, enam cakram daun berdiameter 1 cm dipanen dari petak daun N. benthamiana yang diinfiltrasi agro pada 3 dpai. Setiap sampel direndam dalam 5 mL air suling steril selama 2 jam pada suhu kamar jauh dari cahaya, dan kemudian diganti dengan air suling steril baru untuk menghilangkan elektrolit yang awalnya bocor dari sel-sel yang rusak di tepi cakram daun. Konduktivitas listrik awal kemudian diukur menggunakan alat pengukur konduktivitas DDS-11A (INESA) dan dicatat sebagai E1. 5 mL air steril yang disebutkan di atas yang berisi cakram daun direbus selama 15 menit dan kemudian didinginkan hingga suhu kamar. Konduktivitas listrik kedua diukur dan dicatat sebagai E2. Persentase E1 dan E2 menunjukkan derajat kebocoran elektrolit. Setiap percobaan dilakukan empat kali, dan nilai yang dilaporkan untuk setiap perlakuan menunjukkan rata-rata dari keempat ulangan ini.
Ekstraksi apoplas
Ekstraksi cairan apoplastik dari daun N. benthamiana yang telah diolah dilakukan seperti yang telah dijelaskan sebelumnya (Movahed et al ., 2019 ). Secara singkat, seluruh daun dipanen dan dikenakan infiltrasi vakum dengan buffer isolasi vesikel (VIB), yang terdiri dari 20 mM MES, 2 mM CaCl2 , dan 0,1 M NaCl, yang disesuaikan dengan pH 6. Daun yang terinfiltrasi ditepuk-tepuk dengan lembut untuk menghilangkan cairan berlebih, kemudian dimasukkan ke dalam spuit 30 mL, dan selanjutnya disentrifugasi dalam tabung kerucut 50 mL pada 700g selama 40 menit pada suhu 4 °C untuk memisahkan cairan apoplastik.
Analisis interaksi protein-protein
Untuk pengujian dua-hibrida ragi (Y2H), berbagai kombinasi plasmid ditransformasikan ke dalam galur ragi NMY51 menggunakan sistem membran DUAL, seperti yang dijelaskan sebelumnya (Wu et al ., 2018 ). Untuk pengujian BiFC, gen host dan virus dengan panjang penuh digabungkan dengan daerah N-terminal (nYFP) atau C-terminal (cYFP) dari YFP, masing-masing (Rui et al ., 2022b ). Konstruksi ini kemudian ditransfer ke A. tumefaciens GV3101 melalui elektroporasi dan diinfiltrasi ke daun N. benthamiana berumur tiga minggu . Pencitraan resolusi tinggi dilakukan menggunakan mikroskop confocal Nikon A1R pada 48 jam pasca-infiltrasi (hpi). Untuk uji pencitraan komplementasi luciferase (LCI), vektor pCAMBIA1300-cLUC atau pCAMBIA1300-nLUC digabungkan dengan daerah pengkode protein gen inang dan virus. Setelah 48 jam, daun yang diinfiltrasi agrobacterium dikumpulkan dan disemprot dengan garam kalium D-Luciferin 100 μM dan dilindungi dari cahaya (Zhou et al ., 2018 ). Setelah inkubasi selama 10 menit, sinyal fluoresensi pada daun yang diobati ditangkap menggunakan sistem pencitraan CDD berpendingin cahaya rendah (Amersham Imager 680, GE). Untuk uji ko-imunopresipitasi (Co-IP), buffer lisis nondenaturasi disiapkan dengan menambahkan 0,2 g PVPP, 0,015 g DTT, dan tablet penghambat protease ke dalam 10 mL buffer IP, yang dibuat dengan mencampur 12,5 mL Tris-HCl 1 M, pH 7,5, 50 mL gliserol, 0,186 g EDTA, 4,383 g NaCl, dan 0,1% IGEPAL® CA-630 hingga menjadi 500 mL. Sekitar 0,5 g sampel tanaman, digiling menjadi bubuk dalam nitrogen cair, dicampur dengan 1,5 mL buffer lisis nondenaturasi dan diaduk pada suhu 4 °C selama 30 menit. Setelah disentrifugasi pada suhu 4 °C selama 10 menit pada kecepatan 14.000 g , 100 μL supernatan disisihkan untuk digunakan sebagai input, dan supernatan yang tersisa diinkubasi dengan manik-manik MYC-Trap_MA (Chromotek, Jerman) pada suhu 4 °C selama 2 jam. Manik-manik tersebut kemudian dicuci lima kali dengan buffer IP, diikuti dengan analisis imunoblot.
Perawatan peptida dan kimia
RALF1 matang disintesis oleh Guoping Pharmaceutical Co. Ltd. (Kota Hefei, Tiongkok) dan dilarutkan dalam air steril untuk menyiapkan larutan stok. Untuk persiapan larutan kerja, 2% dimetil sulfoksida (DMSO) digunakan untuk melarutkan Estradiol, menghasilkan konsentrasi akhir 10 μM. 2% DMSO dan air suling steril digunakan untuk menyiapkan larutan kerja 100 mM MG132 (dengan DMSO sebagai kontrol) dan 10 mM 3-MA (dengan air suling steril sebagai kontrol), masing-masing. Larutan ini digunakan untuk perawatan kimia untuk menghambat jalur proteasom 26S dan autofagi (Cheng dan Wang, 2017 ). Pada 2 dpai, daerah yang diinfiltrasi agro diobati dengan larutan kerja MG132 dan 3-MA. Daun diinkubasi selama 8–12 jam tambahan dan kemudian dilakukan analisis imunoblotting.
Analisis statistik
Perangkat lunak ImageJ digunakan untuk memproses gambar yang diperoleh dari percobaan LUC dan untuk mengukur pita pada imunoblot. Untuk analisis statistik, GraphPad Prism 8.0 digunakan untuk menentukan signifikansi menggunakan uji t Student atau ANOVA satu arah. Setidaknya tiga percobaan independen dilakukan, dengan masing-masing percobaan mencakup setidaknya lima replikasi biologis atau tiga replikasi teknis, kecuali dinyatakan lain.




Leave a Reply