ABSTRAK
Kultur perfusi dengan kepadatan sel yang sangat tinggi menjadi semakin menarik untuk pembuatan biologik karena kemampuannya untuk meningkatkan produktivitas dan menawarkan jejak produksi yang fleksibel. Namun, proses perfusi yang intensif ini menimbulkan tantangan, khususnya yang berkaitan dengan kinerja filter serat berongga yang digunakan sebagai perangkat retensi sel. Untuk memfasilitasi penerapannya dalam pembuatan biologik, penting untuk memahami faktor-faktor yang mendorong pengotoran filter dan mengembangkan strategi inovatif untuk mengurangi masalah ini. Dalam studi ini, kami mengembangkan model skala kecil untuk menyelidiki berbagai faktor dalam kultur sel yang memengaruhi pengotoran filter. Kami secara sistematis memeriksa masing-masing komponen, seperti antibusa dan vesikel ekstraseluler, untuk menilai dampaknya terhadap kinerja filter. Data kami menunjukkan bahwa tingkat dan mekanisme pengotoran berbeda di antara komponen-komponen ini, kemungkinan karena variasi dalam distribusi ukuran partikel dan sifat-sifatnya. Selain itu, hasil kami menunjukkan bahwa antibusa berbasis simetikon terakumulasi dari waktu ke waktu dalam kultur perfusi, yang secara signifikan memengaruhi pengotoran. Kami mengamati kesehatan sel yang lebih baik dalam proses perfusi dengan penambahan antibusa minimal. Fraksi pelet yang diisolasi dengan ultracentrifugasi pada 10.000 g dan 100.000 g dari kultur perfusi “Tanpa antibusa” menunjukkan peningkatan kinerja filter yang nyata dalam model offline, yang menyoroti dampak negatif antibusa dalam kultur perfusi. Sebaliknya, varian antibusa alternatif yang tidak bergantung pada simetikon menunjukkan kinerja filter yang lebih baik dalam model offline, yang menekankan peran komposisi antibusa dan membran dalam kecenderungan pengotoran. Studi ini adalah yang pertama kali secara sistematis memeriksa dampak masing-masing komponen dalam kultur perfusi terhadap pengotoran filter. Investigasi lebih lanjut akan sangat penting untuk mengembangkan generasi berikutnya dari proses perfusi yang kuat.
1 Pendahuluan
Kultur perfusi dengan kepadatan sel tinggi menggunakan sel CHO semakin banyak diadopsi untuk pembuatan biologik (Karst et al. 2018 ; Wong et al. 2022 ; Gagnon et al. 2018 ). Proses perfusi intensif biasanya memiliki produktivitas volumetrik yang lebih tinggi yang memungkinkan pengoperasian di fasilitas manufaktur yang lebih kecil dan lebih fleksibel (Pollock et al. 2013 ). Namun, desain dan pengoperasian kultur perfusi kepadatan tinggi yang sukses memerlukan pertimbangan yang cermat terhadap metode retensi sel selama perfusi.
Dalam kultur perfusi yang menggunakan filter serat berongga sebagai perangkat retensi sel, pengotoran filter dapat terjadi seiring waktu (Su et al. 2021 ). Tantangan ini sering kali menyebabkan penghentian batch awal dan berkurangnya transmisi produk (seperti protein dan antibodi) melintasi filter. Strategi saat ini untuk mengurangi pengotoran filter dalam kultur perfusi melibatkan penggantian filter atau mempertahankan kepadatan sel yang lebih rendah dan viabilitas sel yang lebih tinggi. Penggantian filter biasanya hanya berlangsung selama beberapa hari sebelum pengotoran sepenuhnya, dan penggantian filter dalam skala yang lebih besar merupakan tantangan. Selain itu, mempertahankan kepadatan sel yang lebih rendah dan viabilitas sel yang lebih tinggi hanya untuk masalah kinerja filter mungkin membatasi potensi produktivitas proses manufaktur berkelanjutan. Oleh karena itu, pemahaman yang lebih baik tentang penyebab pengotoran filter diperlukan untuk menyadari potensi perfusi dan mengembangkan proses manufaktur yang kuat.
Beberapa faktor telah dihipotesiskan memengaruhi pengotoran filter dan retensi produk. Studi yang mengeksplorasi retensi produk dalam serat berongga menggunakan proses perfusi berbasis ATF atau TFF mengungkapkan bahwa kimia filter, ukuran pori nominal filter, dan fluks filter dapat memengaruhi retensi produk (Su et al. 2021 ; Pinto dan Brower 2020 ; SB Wang et al. 2019 ; Sundar et al. 2023 ; Raza et al. 2024 ; Veje et al. 2024 ). Misalnya, serat berongga polisulfon menunjukkan tingkat retensi produk yang lebih tinggi daripada serat polieter sulfon (Su et al. 2021 ). Ukuran pori yang lebih besar juga memengaruhi retensi produk, tergantung pada distribusi ukuran partikel dalam kaldu kultur sel (Pinto dan Brower 2020 ; SB Wang et al. 2019 ). Sementara aspek-aspek ini berkaitan dengan desain peralatan dan operasional, operasi proses perfusi dapat secara signifikan memengaruhi perilaku seluler. Akibatnya, perubahan dalam komposisi partikel kaldu kultur sel dapat menyebabkan pengotoran filter. Konstituen kultur sel yang dapat memengaruhi kinerja filter diyakini mencakup serpihan sel, vesikel, agen antibusa, DNA, dan protein (Zhang et al. 2024 ). Selain itu, distribusi ukuran vesikel ekstraseluler yang disekresikan dapat bervariasi antara garis sel yang berbeda yang pada gilirannya dapat memengaruhi kecenderungan pengotoran filter secara berbeda (Pinto dan Brower 2020 ). Sementara sebagian besar komponen ini terakumulasi dalam kultur perfusi, tidak ada penelitian yang dapat memodulasi faktor individual untuk mengidentifikasi dengan jelas kontribusi relatif dari masing-masing komponen ini pada kinerja filter.
Faktor-faktor yang menyebabkan pengotoran filter masih kurang diteliti karena tantangan dalam mengisolasi berbagai faktor individual dari percobaan perfusi dalam jumlah yang cukup dan menambahkannya kembali dalam percobaan perfusi yang sebenarnya untuk mempelajari dampaknya. Isolasi masing-masing komponen ini dari kaldu kultur sel perfusi (untuk mewakili apa yang mungkin ada pada titik waktu tertentu dalam perfusi) memerlukan beberapa langkah pemrosesan termasuk ultracentrifugasi atau pemrosesan hilir material. Mempertahankan sterilitas di seluruh operasi ini (tanpa penyaringan untuk menghindari dampak yang tidak disengaja dari penyaringan pada komposisi atau distribusi partikel) dan menambahkan kembali komponen-komponen ini dalam kultur perfusi bisa sangat menantang. Selain itu, mungkin ada dampak kinerja kultur sel karena penambahan komponen pada konsentrasi tinggi yang pada gilirannya dapat membingungkan interpretasi dari percobaan tersebut. Dalam penelitian kami, kami mengembangkan model skala kecil offline yang mensimulasikan perfusi dan memungkinkan evaluasi sistematis berbagai faktor dan dampaknya pada kecenderungan pengotoran filter. Parameter operasi untuk model dioptimalkan untuk menghasilkan data yang representatif. Komponen individual (vesikel ekstraseluler besar, vesikel ekstraseluler kecil [sEV], dan antibusa) diisolasi dari kultur perfusi dan studi spiking dilakukan dalam model skala kecil pada konsentrasi yang relevan. Kami menilai kontribusi relatif dari masing-masing faktor dan menghasilkan wawasan baru ke dalam mekanisme pengotoran filter. Khususnya, antibusa memainkan peran penting dalam meningkatkan kecenderungan pengotoran filter dalam kultur perfusi kepadatan sel tinggi. Hasil menunjukkan bahwa antibusa tidak ada dalam aliran permeat dan terakumulasi secara signifikan dalam kultur perfusi yang dapat berkontribusi pada pengotoran filter. Fraksi pelet dari ultracentrifugasi kaldu utuh kultur sel perfusi pada 10.000 g dan 100.000 g dipelajari dalam model skala kecil untuk menilai kecenderungan pengotoran filter. Hasil menunjukkan bahwa sementara masing-masing fraksi ini dapat menyebabkan pengotoran filter, mekanisme pengotoran dapat berbeda kemungkinan karena perbedaan dalam distribusi ukuran partikel dan komposisi fraksi-fraksi ini. Selain itu, fraksi pelet dari kultur perfusi kepadatan sel tinggi ini juga dapat mengandung kadar antibusa yang signifikan. Untuk lebih menggambarkan kontribusi relatif vesikel ekstraseluler yang ada dalam fraksi pelet dan antibusa ini, kami merancang dan menjalankan penelitian menggunakan pengaturan bioreaktor dengan penambahan antibusa minimal. Fraksi yang diisolasi dari bioreaktor “Tanpa antibusa” ini selanjutnya memvalidasi peran signifikan antibusa dalam menyebabkan pengotoran filter dalam kultur perfusi intensif. Secara keseluruhan, penelitian kami memperkenalkan model skala kecil yang baru untuk mempelajari pengotoran filter dan mengidentifikasi kontribusi relatif vesikel ekstraseluler dan antibusa pada kinerja filter.
2 Bahan dan Metode
2.1 Perluasan Garis Sel dan Inokulum
Lini sel turunan CHO K1 knockout GS rekombinan internal yang mengekspresikan antibodi monoklonal (mAb) digunakan dalam penelitian ini. Rangkaian inokulum diekspansi dalam labu Thomson (Thomson Instrument Company, Oceanside, CA) dalam inkubator pengocok Multitron (Infors HT, Einsbach, Jerman) pada suhu 36,5°C dengan 5% CO 2 . Media bebas serum komersial digunakan untuk peningkatan skala kultur benih.
2.2 Kultur Perfusi
Percobaan perfusi dalam bioreaktor dilakukan pada skala 3 atau 50 L untuk menghasilkan material bagi studi skala kecil offline. Pengoperasian bioreaktor dengan penambahan antibusa minimal dan antibusa berlebih dilakukan pada skala 3 L.
2.2.1 Percobaan Perfusi 3 L
Bioreaktor kaca 3 L dengan volume kerja total 1,8 L (diproduksi oleh Sartorius AG, Goettingen, Jerman) digunakan untuk eksperimen perfusi selama periode 28 hari. Media batching adalah media komersial yang sama yang juga digunakan untuk ekspansi inokulum. Sel diinokulasi dalam bioreaktor produksi pada kepadatan sel 0,5 × 106 sel /mL. pH dipertahankan dalam kisaran 7,1 ± 0,2 menggunakan semprotan CO2 atau natrium karbonat 1 M, sesuai kebutuhan. Suhu dipertahankan pada 36,5°C, dan DO dipertahankan pada 40% menggunakan kombinasi cincin O2 dan semprotan frit, dengan semprotan udara terus menerus. Agitasi ditingkatkan mulai Hari ke-5. Perfusi menggunakan media internal milik sendiri dimulai pada 1 volume pembuluh per hari (VVD) pada Hari ke-3 dan ditingkatkan menjadi 2 VVD mulai Hari ke-5 dan seterusnya. Glukosa dipertahankan menggunakan pakan terpisah antara 2 dan 3 g/L berdasarkan tingkat konsumsi harian. Filter Microza 0,2 µm UMP-1047R yang terbuat dari polivinilidena difluorida (Asahi Kasei Bioprocess America, Glenview, IL) digunakan untuk retensi sel. 1% simetikon EX-CELL antibusa (Sigma-Aldrich, St. Louis, MO) ditambahkan mulai hari ke-3 pada 0,2 mL/jam, ditingkatkan menjadi 0,6 mL/jam pada Hari ke-5, diikuti dengan mempertahankan 1 mL/jam dari Hari ke-7 hingga akhir proses. Kepadatan sel dipantau secara terus-menerus menggunakan probe biokapasitas (Hamilton, Reno, NV) dan dipertahankan pada 85 pF/cm melalui pendarahan sel otomatis.
2.2.2 Percobaan Perfusi 50 L
Untuk mengisolasi fraksi ukuran berbeda dari kaldu kultur sel perfusi, ultracentrifugasi digunakan dan pelet yang diisolasi pada gaya g berbeda dipelajari untuk kontribusi potensialnya terhadap pengotoran filter. Dalam hal ini, untuk menghasilkan fraksi pelet 10.000 g dan 100.000 g yang cukup untuk studi spike-in offline dalam model skala kecil (dijelaskan dalam bagian berikutnya), kami melakukan perfusi berjalan pada skala 50 L. Kami menggunakan bioreaktor sekali pakai Xcellerex XDR 50 L (Cytiva, MA, AS) yang diinokulasi dengan kepadatan sel 0,5 × 106 sel /mL. Prosesnya sangat mirip dengan eksperimen perfusi 3 L. Secara khusus, kami mengendalikan oksigen terlarut (DO) pada 40% dari saturasi udara menggunakan O2 murni dan mempertahankan pH pada 7,1 ± 0,2. Perfusi dimulai pada Hari ke-3 pada 0,5 VVD dan secara bertahap ditingkatkan menjadi 2 VVD pada Hari ke-5. Agitasi diatur pada 86 rpm, dan 1% simetikon EX-CELL antibusa (Sigma-Aldrich, St. Louis, MO) ditambahkan sesuai kebutuhan untuk pengendalian busa. Perdarahan diatur berdasarkan pembacaan biokapasitas, dan kultur dipertahankan pada titik setel kapasitansi 85 pF/cm. Sistem perfusi KrosFlow KPS (Repligen, Waltham, MA) dengan filter serat berongga TFF (Asahi Kasei Microza 0,2 µm UMP-3147R, Pall, Port Washington, NY) digunakan untuk perfusi.
2.2.3 Percobaan Bioreaktor “Tanpa Antibusa”
Untuk mempelajari dampak antibusa pada kultur sel dan kinerja filter, pengaturan bioreaktor 3 L dirancang seperti yang ditunjukkan pada Informasi Pendukung S1: Gambar S5 . Kekhawatiran utama dari tidak menambahkan antibusa adalah risiko busa yang tidak terkendali membasahi filter pembuangan dan membahayakan sterilitas batch. Untuk mengurangi kekhawatiran ini, dua jalur dibangun, salah satunya memungkinkan busa keluar ke carboy yang berisi antibusa dan jalur lain yang memiliki botol 2 L yang ditempatkan lebih tinggi dari bioreaktor dan filter pembuangan dipasang pada botol ini. Selain itu, impeller kedua dipasang pada poros pada posisi yang lebih tinggi dari permukaan cairan. Ini bertindak sebagai pemecah busa parsial. Karena desain khusus dari pengaturan bioreaktor dan keterbatasan sejumlah port pada pelat kepala, perfusi dijalankan dalam mode ATF daripada TFF. Terlepas dari desain reaktor dan pembuangan umpan antibusa terus-menerus, seperti yang dijelaskan dalam bagian eksperimen perfusi 3 L, parameter proses lainnya tetap sama dengan kontrol. Setelah Hari ke-10, busa tidak keluar dengan bebas dari pipa yang terhubung ke carboy karena diameter saluran yang kecil. Untuk menghindari tekanan lebih lanjut yang menyebabkan fluktuasi aliran ATF yang digerakkan secara vakum, satu atau dua suntikan 1 mL antibusa 1% ditambahkan pada hari-hari tertentu. Total antibusa yang ditambahkan dalam proses ini setidaknya 24 kali lebih rendah daripada yang ditambahkan dalam bioreaktor kontrol.
2.2.4 Percobaan Bioreaktor “Antibusa Berlebih”
Kondisi penyiapan dan proses dipertahankan sama dengan bioreaktor kontrol. Satu-satunya perbedaan adalah laju penambahan antibusa menjadi dua kali lipat dibandingkan dengan proses kontrol.
2.2.5 Percobaan Bioreaktor Kontrol “Viabilitas Tinggi”
Kondisi proses tetap sama dengan bioreaktor kontrol. Satu-satunya perbedaan adalah rakitan tabung yang digunakan untuk sistem TFF dimodifikasi untuk meningkatkan waktu tinggal cairan kultur dalam loop TFF dari 8 detik (kondisi kontrol) menjadi 30 detik. Laju penambahan antibusa tetap sama dengan kontrol (Tiffany Tang et al. 2024 ).
2.3 Isolasi Fraksi Pelet 10.000 g dan 100.000 g untuk Studi Spike-in
Proses isolasi untuk fraksi pelet 10.000 g dan 100.000 g menggunakan ultracentrifugasi diadopsi dari metode yang dilaporkan sebelumnya (Zhang et al. 2024 ; Veziroglu dan Mias 2020 ; Thery 2006 ). Secara khusus, kaldu kultur sel disentrifugasi pada 450x g selama 10 menit untuk mengisolasi sel. Supernatan kemudian disentrifugasi pada 1000x g selama 10 menit dua kali untuk menghilangkan pelet yang mengandung serpihan seluler. Supernatan yang dihasilkan diputar pada 10.000x g selama 30 menit untuk memperoleh fraksi pelet 10.000 g yang mengandung vesikel ekstraseluler besar. Supernatan selanjutnya disentrifugasi pada 100.000x g selama 70 menit untuk mengisolasi 100.000 g pelet yang mengandung sEV.
2.4 Model Skala Kecil Offline untuk Pengotoran Filter dan Penyaringan Produk
Dalam model skala kecil offline, filter PES Microkros 0,2 µm (dengan luas permukaan 26 atau 13 cm²) digunakan untuk mensimulasikan pengotoran filter. Karena ketersediaan filter, dua area filter yang berbeda digunakan untuk eksperimen. Reservoir sampel, dicampur menggunakan pengaduk magnetik, mewakili reaktor. Sensor tekanan Pendotech dihubungkan pada port masuk dan keluar filter. sEV yang diisolasi dari kaldu utuh Hari ke-26 dicampur ke dalam media segar yang mengandung 1−1,5 g/L mAb yang dimurnikan. Kondisi lonjakan 1x meniru fraksi partikel yang ada pada Hari ke-26 bioreaktor perfusi. Kondisi lonjakan tersebut secara individual diputar melalui serat berongga PES 0,2 µm. Laju aliran permeat, yang dikontrol oleh pompa peristaltik, awalnya diatur agar sesuai dengan fluks skala besar (~4,4 LMH). Kemudian, laju aliran permeat ditingkatkan sebesar 30% untuk mengamati perubahan tekanan transmembran (TMP). Penggandaan laju aliran silang selanjutnya menyelidiki dinamika pengotoran. Konsentrasi IgG dalam sampel “reaktor” dan permeat memungkinkan perhitungan penyaringan produk seketika.
3 Hasil
3.1 Pengembangan Model Offline Skala Kecil untuk Mengevaluasi Dampak Berbagai Faktor yang Dapat Menyebabkan Fouling dan Retensi Produk dalam Perfusi
Kaldu kultur sel perfusi adalah campuran kompleks yang berisi sel, serpihan sel, antibusa, vesikel ekstraseluler, protein, DNA, dan produk sampingan seluler lainnya yang membuatnya sulit untuk menggambarkan dampak dan tingkat dampak faktor-faktor individual pada kinerja perangkat retensi sel. Mempelajari hal ini secara sistematis dalam proses perfusi waktu nyata adalah rumit karena sulit untuk memanipulasi faktor-faktor individual tanpa menyebabkan efek yang tidak sesuai target pada kinerja kultur sel. Untuk tujuan ini, model skala kecil offline dikembangkan untuk mempelajari hubungan kausal antara berbagai komponen dalam kultur sel dan bagaimana mereka memengaruhi pengotoran dan kecenderungan retensi produk dari perangkat retensi sel. Tujuan dari model ini adalah untuk mendapatkan wawasan kualitatif ke dalam kontribusi relatif dari berbagai komponen pada kinerja filter. Sasaran untuk desain model skala kecil adalah: (I) Jalur aliran representatif, laju aliran fluida, dan fluks; (ii) kemampuan untuk menangani volume sampel kecil; (iii) kemampuan untuk memanipulasi sampel untuk menguji berbagai faktor dan dampaknya pada kinerja filter; (iv) kemampuan untuk mengukur pengotoran filter dan profil penyaringan produk dari waktu ke waktu; (v) kemampuan untuk membedakan antara kondisi perlakuan yang berbeda dan dampaknya terhadap pengotoran dan penyaringan; (vi) menyelesaikan percobaan dalam waktu 6 jam.
Skema model luring ini ditunjukkan pada Gambar 1. Filter 13 cm2 yang terdiri dari dua filter serat berongga PES dengan ukuran pori nominal 0,2 µm dan ID 1 mm digunakan. Reservoir sampel yang biasanya berisi volume total dalam kisaran 100−150 mL digunakan untuk penelitian. Jalur aliran selama pengaturan eksperimen tipikal digambarkan dalam gambar. Garis aliran silang dan permeat diarahkan ke reservoir sampel yang sama untuk menghemat volume selama percobaan. Tekanan dipantau di semua titik masuk dan keluar filter untuk memantau TMP selama percobaan. Pada interval tertentu, sampel dikumpulkan dari garis permeat dan reservoir sampel untuk mengukur konsentrasi protein selama percobaan.
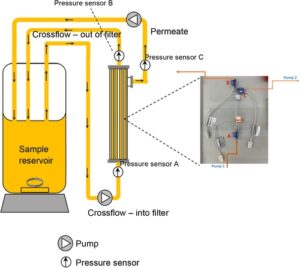
Parameter untuk mengoperasikan model skala kecil dioptimalkan untuk memastikan bahwa kesimpulan dari penelitian tersebut representatif dan akan membantu menghasilkan hipotesis mengenai tantangan kinerja filter dalam kultur perfusi aktual. Hal ini dijelaskan dalam Tabel 1 .
| Parameter | Parameter studi saat ini |
|---|---|
| ID Lumen | 1 juta |
| Jumlah lumen | 2 |
| Daerah penyaringan | 13cm2 |
| Laju aliran permeat | Diukur berdasarkan fluks a |
| Laju aliran silang | 4–8 mL/menit |
| Bahan penyaring | PES |
| Durasi Studi | 6−7 jam |
| Pengambilan sampel | Setiap 30/60 menit |
a Mempertahankan fluks yang sama atau sedikit lebih tinggi (~4,4 LMH) selama 1−2 jam awal percobaan dan kemudian meningkat selama sisa percobaan. Strateginya adalah dapat melihat kejadian pengotoran dan penyaringan dan membandingkannya dengan “kontrol perlakuan.”
Model skala kecil dioptimalkan menggunakan sampel yang diperoleh dari 50 L perfusi run, profil kultur sel yang ditunjukkan pada Informasi Pendukung S1: Gambar S1 . Informasi Pendukung S1: Gambar S2 mengilustrasikan beberapa profil TMP dan penyaringan dari percobaan skala kecil menggunakan kaldu utuh dan supernatan 450 g dari Hari ke-16 dari proses perfusi intensif. Laju aliran permeat dimodifikasi langkah demi langkah untuk mengubah fluks melalui filter dan perubahan TMP dipantau. Seperti yang diharapkan, dengan laju aliran permeat awal 0,2 mL/menit, TMP meningkat dengan cepat. Mengurangi laju aliran menjadi 0,12 mL/menit memungkinkan kita untuk mengamati pengotoran filter secara bertahap. Berdasarkan penelitian ini, parameter untuk mengoperasikan model skala kecil dioptimalkan untuk menyeimbangkan kemampuan membedakan antara kecenderungan pengotoran dari kondisi yang berbeda serta memastikan bahwa pengotoran diamati dalam durasi percobaan 6-7 jam.
3.2 Fraksi Pelet 10.000 g dan 100.000 g Memiliki Mekanisme Pengotoran yang Berbeda
Kultur sel, terutama kultur perfusi kepadatan sel tinggi, terdiri dari sel, serpihan sel, vesikel ekstraseluler, protein, DNA, komponen media, dan produk sampingan seluler. Beberapa faktor telah terlibat dalam menyebabkan pengotoran filter atau masalah penyaringan produk. Misel antibusa dideteksi pada permukaan membran serat berongga yang terkotori oleh Kelly et al. ( 2014 ). Menggunakan analisis pelacakan nanopartikel (NTA), Zhang et al. ( 2024 ) melaporkan tingkat tinggi vesikel ekstraseluler dengan ukuran berbeda (vesikel ekstraseluler besar dan sEV) yang terakumulasi dari waktu ke waktu dalam kultur perfusi kepadatan sel tinggi. Memahami peran relatif dari masing-masing faktor potensial dalam eksperimen perfusi nyata sangat menantang karena beberapa faktor seperti kuantitas komponen individu yang dibutuhkan serta kebutuhan untuk menjaga sterilitas dalam eksperimen perfusi sejati. Kami memanfaatkan model skala kecil offline untuk mempelajari dampak fraksi pelet 10.000 g dan 100.000 g yang diduga terutama mengandung vesikel ekstraseluler besar (kisaran ukuran 200–1000 nm) dan sEV (kisaran ukuran 50–200 nm), masing-masing (Busch et al. 2022 ).
Ultracentrifugasi digunakan untuk mengisolasi fraksi ukuran berbeda dari Hari ke-26 kultur perfusi kepadatan sel tinggi yang dijalankan pada skala 50 L (Informasi Pendukung S1: Gambar S1 ) seperti yang dijelaskan sebelumnya. Konsentrasi berbeda dari fraksi pelet 10.000 g (4X dan 7X) atau fraksi pelet 100.000 g (2,5X, 5X, dan 12X) ditambahkan ke media perfusi yang mengandung 1 g/L model mAb dan diuji dalam model. Profil pengayakan TMP dan produk ditunjukkan pada Gambar 2. Konsentrasi 1X dari fraksi pelet 10.000 g dan 100.000 g sesuai dengan konsentrasi fraksi-fraksi ini yang akan ada pada Hari ke-26 kultur perfusi.
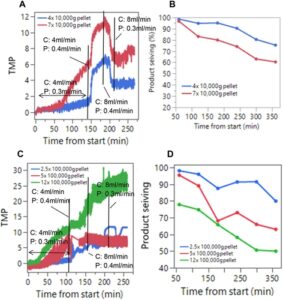
Pengotoran yang bergantung pada konsentrasi dan penyaringan produk juga diamati untuk kedua fraksi. Namun, fraksi-fraksi ini harus ditambahkan pada tingkat yang jauh lebih tinggi daripada konsentrasinya pada Hari ke-26 dari proses perfusi untuk mengamati pengotoran dan retensi produk (perlu dicatat bahwa studi penambahan yang dilakukan dalam model skala kecil offline dilakukan pada konsentrasi tinggi untuk memungkinkan perbandingan relatif kecenderungan pengotoran filter di berbagai kondisi, daripada untuk menentukan konsentrasi spesifik di mana pengotoran dapat terjadi dengan fraksi tertentu. Simulasi diselesaikan dalam waktu 6-8 jam, dan untuk mengamati kejadian pengotoran, konsentrasi penambahan sengaja dibuat lebih tinggi daripada yang biasanya ditemukan di seluruh kaldu kultur sel). Menariknya, mekanisme pengotoran filter yang disebabkan oleh masing-masing fraksi ini berbeda. Untuk kedua fraksi, ketika laju aliran permeat ditingkatkan dari 0,3 menjadi 0,4 mL/menit, peningkatan fluks filter sebesar 33%, peningkatan TMP diamati seperti yang diharapkan. Namun, ketika laju aliran silang ditingkatkan dari 4 menjadi 8 mL/menit, TMP menurun untuk fraksi pelet 10.000 g yang dicampur sedangkan fraksi pelet 100.000 g mengalami peningkatan TMP yang terus-menerus. Hal ini menunjukkan bahwa pengotoran filter yang diamati dengan fraksi pelet 10.000 g mungkin sebagian disebabkan oleh pembentukan lapisan kue pada permukaan filter yang sebagian tercuci ketika laju aliran silang ditingkatkan. Namun, dalam kasus fraksi pelet 100.000 g , pengotoran filter mungkin terutama disebabkan oleh penyumbatan pori dan oleh karena itu peningkatan laju aliran silang tidak menurunkan TMP.
Perbedaan mekanisme pengotoran filter antara fraksi pelet 10.000 g dan 100.000 g mungkin disebabkan oleh perbedaan distribusi ukuran partikelnya (Hayati et al. 2025 ; Kapila et al. 2025 ; Zainol Abidin et al. 2022 ; Haramkar et al. 2021 ). Fraksi pelet 100.000 g sebagian besar mengandung partikel dengan ukuran berkisar antara 50 hingga 200 nm. Sebaliknya, fraksi pelet 10.000 g memiliki partikel yang lebih besar dengan ukuran berkisar antara 200 hingga 1000 nm (Busch et al. 2022 ). Karena ukuran pori nominal filter retensi sel (dan filter model skala kecil) adalah 200 nm, kemungkinan partikel yang lebih kecil di sekitar kisaran ini dalam fraksi pelet 100.000 g mungkin sebagian besar menyebabkan penyumbatan pori pada filter serat berongga.
3.3 Antifoam Terakumulasi di Bioreaktor Selama Proses Perfusi dan Dapat Menyebabkan Pengotoran Filter
Kultur perfusi kepadatan sel tinggi memerlukan laju aliran gas tinggi untuk mendukung permintaan oksigen. Hal ini mengakibatkan masalah busa yang berlebihan dan oleh karena itu sejumlah besar antibusa ditambahkan (Flynn 2024 ). Biasanya, simetikon (emulsi silikon) digunakan sebagai agen antibusa dalam kultur sel mamalia. Gambar 3A menunjukkan distribusi ukuran partikel antibusa simetikon yang diukur menggunakan NTA. Partikel yang lebih besar (> 1 µm) juga diamati dalam emulsi seperti yang terlihat pada gambar saat antibusa yang diencerkan dijalankan pada sistem penghitung sel (Informasi Pendukung S1: Gambar S3 ). Bersama-sama, ini menunjukkan bahwa simetikon memiliki rentang distribusi ukuran partikel yang luas dari 50 hingga beberapa mikron.
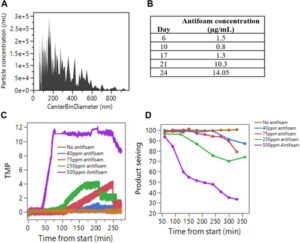
Perangkat retensi sel berbasis membran (ATF/TFF) memiliki ukuran pori nominal 0,2 µm, yang lebih kecil dari kisaran ukuran partikel antibusa. Oleh karena itu, kami menguji apakah antibusa terakumulasi dalam bioreaktor perfusi selama durasi kultur. Dalam hal ini, sampel yang tidak disaring dikumpulkan dari bioreaktor dan permeat pada titik waktu kultur yang berbeda dan konsentrasi simetikon diukur menggunakan silikon ICP-OES. Seperti yang ditunjukkan pada Gambar 3B , peningkatan lebih dari 10 kali lipat dalam konsentrasi antibusa diamati dalam bioreaktor pada Hari ke-24 jika dibandingkan dengan Hari ke-6. Kadar ini setara dengan sekitar 250−500 ppm antibusa. Jumlah antibusa yang dapat diabaikan diamati dalam sampel permeat (data tidak ditampilkan), sejalan dengan fakta bahwa simetikon tidak melewati filter. Meskipun data ini menunjukkan bahwa antibusa terakumulasi dalam kultur perfusi hingga tingkat yang sangat tinggi, tampaknya antibusa yang terakumulasi ini tidak efektif dalam kemampuan menghilangkan busa. Hal ini terbukti dari fakta bahwa busa yang signifikan diamati dalam kultur perfusi selama durasi kultur (bahkan pada keadaan pseudo-stabil saat VCD target dipertahankan) yang memerlukan penambahan terus-menerus, yang jika tidak ada akan menyebabkan busa keluar dari bioreaktor.
Pengotoran filter pada bioreaktor perfusi dengan kepadatan sel tinggi terjadi pada bagian akhir proses, yang bertepatan dengan waktu ketika akumulasi antibusa yang signifikan (hingga 10 kali lipat) terlihat. Antibusa telah terbukti memengaruhi pengotoran membran ultrafiltrasi (McGregor et al. 1988 ). Selain itu, laporan sebelumnya telah menunjukkan adanya antibusa pada permukaan filter menggunakan mikroskop elektron (Kelly et al. 2014 ). Namun, belum ada penelitian yang mengevaluasi peran potensial akumulasi antibusa dan dampaknya pada pengotoran filter ATF/TFF dalam kultur perfusi CHO.
Kami menggunakan model skala kecil untuk menguji apakah antibusa memiliki kecenderungan untuk mengotori filter yang digunakan untuk retensi sel. Konsentrasi antibusa simetikon yang berbeda (40−500 ppm) ditambahkan ke dalam media perfusi yang mengandung 1,5 g/L contoh mAb dan diuji dalam model skala kecil. Profil penyaringan TMP dan produk ditunjukkan pada Gambar 3. Peningkatan TMP yang signifikan dan penyaringan produk diamati pada antibusa 75−250 ppm dan pengotoran filter yang lengkap dan segera diamati pada antibusa 500 ppm yang mengakibatkan tidak ada aliran yang keluar dari saluran permeat. Konsentrasi di mana pengotoran filter dan dampak penyaringan produk diamati berada pada tingkat relevan yang terakumulasi dalam bioreaktor selama durasi kultur perfusi (seperti yang diukur pada Gambar 3B ). Data ini menunjukkan, untuk pertama kalinya, peran antibusa dalam kultur perfusi pada pengotoran filter dan penyaringan produk.
Untuk mendapatkan wawasan tentang mekanisme potensial pengotoran filter karena antibusa, kami melakukan eksperimen dengan 250 ppm antibusa dalam model skala kecil. Setelah pengotoran signifikan diamati menggunakan laju aliran permeat khas 0,2 mL/menit, laju aliran silang ditingkatkan dari 4 menjadi 8 mL/menit, ~35% penurunan TMP diamati (Informasi Pendukung S1: Gambar S4 ). Ini menunjukkan kontribusi parsial dari pembentukan lapisan kue. Setelah ini, aliran garis permeat dibalik untuk meniru backflush yang mengakibatkan TMP kembali ke garis dasar yang menunjukkan bahwa sisa pengotoran mungkin disebabkan oleh penyumbatan pori filter serat berongga.
Ultracentrifugasi memisahkan partikel berdasarkan ukuran. Karena distribusi ukuran partikel antibusa berkisar dari 50 nm hingga beberapa mikron, fraksi pelet 10.000 g dan 100.000 g dari ultracentrifugasi supernatan kultur sel mungkin secara inheren juga mengandung partikel antibusa selain vesikel ekstraseluler besar dan kecil. Untuk menguji ini, kami mengukur konsentrasi antibusa dari fraksi pelet 10.000 g dan 100.000 g dari Hari ke-26 kultur perfusi. Memang, konsentrasi antibusa yang setara dengan sekitar 5 dan 25 ppm ditemukan di masing-masing fraksi ini, masing-masing (pada konsentrasi 1X dari fraksi ini). Karena dampak pengotoran filter yang signifikan dengan fraksi pelet 10.000 g dan 100.000 g dalam model skala kecil offline terlihat pada konsentrasi lonjakan > 4X, konsentrasi antibusa dalam studi lonjakan mungkin signifikan (> 20−100 ppm). Ini menunjukkan bahwa pengamatan dari kecenderungan pengotoran filter dari masing-masing fraksi ini yang diperoleh dari bioreaktor kontrol mungkin dipengaruhi oleh keberadaan antibusa.
3.4 Bioreaktor Perfusi “Tanpa Antibusa” Menyoroti Dampak Negatif Antibusa pada Kesehatan Sel dan Kecenderungan Pengotoran Filter
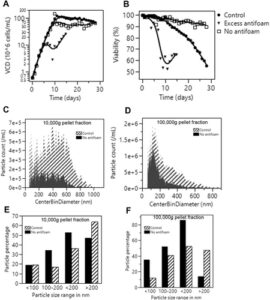
Data dari model skala kecil menunjukkan bahwa antibusa dalam kultur perfusi mungkin terakumulasi dari waktu ke waktu dan selanjutnya menyebabkan pengotoran filter dan penyaringan produk. Untuk menguji hipotesis ini, kami merancang pengaturan bioreaktor yang disebut bioreaktor “Tanpa antibusa” (Informasi Pendukung S1: Gambar S5 ) di mana tidak ada/sedikit antibusa yang ditambahkan. Kondisi bioreaktor antibusa berlebih juga dievaluasi, di mana dua kali lipat jumlah antibusa yang ditambahkan jika dibandingkan dengan kondisi kontrol. Parameter proses lainnya dipertahankan sama dengan kondisi kontrol. Profil pertumbuhan dan viabilitas sel dari ketiga kondisi ini ditunjukkan pada Gambar 4A,B . Baik kondisi kontrol maupun tanpa antibusa mempertahankan kepadatan sel target yang sebanding sebesar 85−100 × 106 sel /mL dari Hari ke-10 hingga Hari ke-28. Menariknya, sel dalam kondisi “Tanpa antibusa” mempertahankan viabilitas yang sangat tinggi (>90%) selama keseluruhan durasi 28 hari, sedangkan viabilitas kondisi kontrol menurun terus menerus hingga sekitar 55%. Di sisi lain, kondisi antibusa berlebih telah menghambat pertumbuhan sel dan mengakibatkan penurunan viabilitas yang lebih cepat. Kondisi antibusa berlebih hanya berlangsung selama 14 hari setelah itu filter menjadi kotor sepenuhnya dan tidak ada aliran di saluran permeat. Data ini sejalan dengan hipotesis bahwa kadar antibusa yang tinggi dapat menyebabkan pengotoran filter.
Pada Hari ke-28, seluruh kaldu dari bioreaktor dikumpulkan dari kedua kondisi kontrol dan “Tanpa antibusa” dan dikenakan langkah sentrifugasi serial pada 450 g dan 1000 g untuk membuang sel dan serpihan sel. Setelah ini, ultracentrifugasi dilakukan pada supernatan 1000 g untuk memisahkan fraksi pelet 10.000 g dan 100.000 g seperti yang dijelaskan di bagian sebelumnya. Konsentrasi antibusa diukur dalam fraksi pelet 10.000 g dan 100.000 g . Seperti yang diharapkan, kondisi “Tanpa antibusa” tidak memiliki antibusa yang terdeteksi dalam fraksi ini, sedangkan kondisi kontrol memiliki ~4 ppm antibusa dalam fraksi pelet 10.000 g ; ~35 ppm dalam fraksi supernatan 10.000 g , 20 ppm dalam fraksi pelet 100.000 g , dan 15 ppm dalam fraksi supernatan 100.000 g . Studi spiking dengan fraksi-fraksi ini, di mana pengotoran dalam model skala kecil diamati pada konsentrasi > 2X, mungkin disebabkan oleh kombinasi antibusa dan vesikel ekstraseluler.
Perlu dicatat bahwa secara visual, supernatan kultur sel dalam kondisi “tanpa antibusa” secara signifikan lebih jernih dibandingkan dengan kondisi kontrol. Ini juga terbukti dari analisis distribusi ukuran partikel dari fraksi pelet 10.000 g dan fraksi pelet 100.000 g , seperti yang ditunjukkan pada Gambar 4C,D . Pada konsentrasi 1X dari pelet 10.000 g , jumlah total partikel ~10 kali lipat lebih rendah dalam kondisi “Tanpa antibusa” jika dibandingkan dengan kontrol. Menariknya, ukuran partikel relatif dari fraksi pelet ketika dinormalisasi ke jumlah total partikel juga berbeda (Gambar 4D ). Sementara kondisi “Tanpa antibusa” memiliki jumlah partikel yang lebih besar yang < 200 nm, kondisi kontrol memiliki partikel > 200 nm yang secara signifikan lebih tinggi.
Karena viabilitas sel dalam bioreaktor “Tanpa antibusa” secara signifikan lebih tinggi daripada kondisi kontrol, tidak jelas apakah kultur yang secara signifikan lebih jernih dari kondisi “Tanpa antibusa” disebabkan oleh tingkat antibusa yang sangat rendah atau karena tingkat serpihan sel yang lebih rendah. Penelitian sebelumnya telah menunjukkan bahwa operasi TFF dapat menyebabkan tekanan geser yang signifikan pada sel dalam kultur perfusi (S. Wang et al. 2017 ). Memodifikasi pompa TFF atau rakitan filter dapat membantu mengurangi tekanan ini, meningkatkan viabilitas dan produktivitas sel (Marcella Yu et al. 2018 ). Misalnya, mengganti pompa peristaltik dengan pompa sentrifugal geser rendah telah ditemukan untuk meningkatkan pertumbuhan dan viabilitas sel. Untuk menggambarkan efek antibusa dan viabilitas pada pengotoran filter, kami menjalankan kondisi kontrol “viabilitas tinggi” yang memiliki tingkat penambahan antibusa yang sebanding dengan kontrol tetapi memiliki tren viabilitas yang mirip dengan kondisi bioreaktor “Tanpa antibusa”. Hal ini dicapai dengan mengubah rakitan tabung dari pengaturan TFF sehingga waktu tinggal cairan kultur sel dalam rakitan TFF adalah 30 detik (8 detik untuk kondisi kontrol) (Tiffany Tang et al. 2024 ). Profil kultur sel dari kondisi “Tanpa antibusa,” kontrol, dan kontrol “viabilitas tinggi” ditunjukkan dalam Informasi Pendukung S1: Gambar S6 . Fraksi pelet 10.000 g dan 100.000 g diisolasi dari ketiga kondisi bioreaktor. Distribusi ukuran partikel dan konsentrasi partikel ditunjukkan dalam Informasi Pendukung S1: Gambar S7 . Seperti yang terlihat di sini, bahkan dengan viabilitas yang lebih tinggi untuk kontrol “viabilitas tinggi”, ukuran partikel dan konsentrasi partikel secara signifikan lebih tinggi daripada kondisi “Tanpa antibusa” dan lebih sebanding dengan kondisi kontrol.
Kami kemudian menilai dampak dari fraksi yang berbeda dari kontrol, kontrol “viabilitas tinggi”, dan kondisi “Tanpa antibusa” pada kecenderungan pengotoran filter dalam model skala kecil. Gambar 5 menunjukkan profil TMP untuk operasi skala kecil menggunakan fraksi dari dua kondisi. Untuk fraksi pelet 10.000 g , dampak yang bergantung pada konsentrasi pada kecenderungan pengotoran filter diamati untuk ketiga kondisi. Untuk sampel kontrol, konsentrasi 2X dari pelet 10.000 g menunjukkan peningkatan bertahap dalam TMP, sedangkan konsentrasi 4X mengotori secara instan. Di sisi lain, untuk fraksi pelet 10.000 g yang diisolasi dari kondisi “Tanpa antibusa”, tidak ada peningkatan TMP yang diamati pada konsentrasi 4X. Hanya ketika konsentrasi lonjakan ditingkatkan lebih lanjut secara signifikan menjadi 7X, peningkatan TMP tingkat rendah yang bertahap diamati. Peningkatan TMP ini jauh lebih rendah daripada kondisi lonjakan 2X untuk fraksi kontrol.
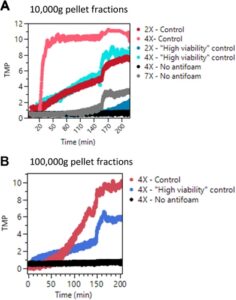
Demikian pula, untuk fraksi pelet 100.000 g yang dijalankan pada konsentrasi 4X, sementara kondisi kontrol menunjukkan tanda-tanda pengotoran filter (terbukti dari peningkatan TMP seperti yang terlihat pada Gambar 5B ), tidak ada pengotoran yang diamati untuk konsentrasi yang sama dari kondisi “Tanpa antibusa”. Karena tantangan dalam mengisolasi fraksi pelet 100.000 g yang cukup , kami tidak dapat menguji batas di mana fraksi ini dari kondisi “Tanpa antibusa” mungkin mulai menunjukkan tanda-tanda pengotoran.
Secara keseluruhan, data menunjukkan bahwa antibusa memainkan peran penting dalam meningkatkan kecenderungan terjadinya pengotoran filter dalam kultur perfusi dengan kepadatan sel tinggi. Penting untuk digarisbawahi bahwa meskipun kinerja filter meningkat, kami mencatat retensi produk yang cukup besar dalam skenario “Tanpa antibusa” (lihat Informasi Pendukung S1: Gambar S8 ). Hal ini menunjukkan bahwa faktor-faktor yang berkontribusi terhadap pengotoran mungkin berbeda dari faktor-faktor yang terlibat dalam penyaringan, yang berpotensi mencakup vesikel ekstraseluler, DNA, protein sel inang, dan lain-lain.
3.5 Antibusa yang Berbeda Memiliki Kecenderungan Pengotoran dan Penyaringan yang Berbeda
Laporan sebelumnya telah melaporkan bahwa kimia filter dapat berdampak pada kecenderungan pengotoran. Ini mungkin didorong oleh mekanisme interaksi yang berbeda antara permukaan filter dan pengotoran. Kami menyelidiki apakah antibusa yang berbeda dapat memiliki kecenderungan pengotoran filter yang berbeda. Dalam hal ini, Antifoam 204 adalah antibusa organik yang telah digunakan dalam fermentasi mikroba (Flynn 2024 ). Ini adalah campuran defoamer organik non-silikon, berbeda dengan simetikon. 250 dan 500 ppm Antifoam 204 dicampur secara individual ke dalam media perfusi yang mengandung 1 g/L contoh mAb. Ini kemudian dijalankan pada model skala kecil. Gambar 6 menunjukkan profil TMP dan penyaringan. Seperti yang terlihat di sini, tidak ada pengotoran filter atau retensi produk yang diamati bahkan pada konsentrasi antifoam tinggi 500 ppm. Selain itu, sistem tersebut semakin tertantang dengan meningkatkan laju aliran permeat sebesar 10 kali lipat (yang akan meningkatkan fluks 10 kali lipat). Namun, bahkan dalam kondisi ini, tidak ada peningkatan TMP yang tercatat. Data ini menunjukkan bahwa berbagai bahan kimia antibusa dapat memiliki kecenderungan pengotoran yang berbeda.
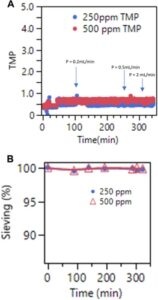
Kami menguji kelayakan penggunaan Antifoam 204 dalam kultur sel CHO. Dalam hal ini, sel CHO disemai dalam bioreaktor ambr15 pada dua kepadatan penyemaian yang berbeda (0,5 × 106 atau 5 × 106 sel /mL) dalam media yang mengandung berbagai konsentrasi antifoam simetikon atau Antifoam 204 (0, 25, 50, atau 100 ppm) (Informasi Pendukung S1: Gambar S9 ). Konsisten dengan efek penghambatan pada pertumbuhan sel yang terlihat dalam bioreaktor “antifoam berlebih” 3 L, kami mengamati efek penghambatan antifoam simetikon yang bergantung dosis pada pertumbuhan sel. Namun, antifoam 204 secara signifikan lebih beracun bagi sel CHO pada semua konsentrasi yang diuji. Walaupun data ini menunjukkan bahwa Antifoam 204 tidak cocok untuk kultur sel CHO, namun hal ini membuka kemungkinan kimia antifoam alternatif yang cocok untuk kultur sel CHO dan untuk mengurangi kecenderungan terjadinya pengotoran filter pada kultur perfusi.
4 Kesimpulan
Pengotoran filter merupakan salah satu penyebab utama penghentian dini kultur perfusi dengan kepadatan sel tinggi. Dalam skala besar, penggantian filter dapat dilakukan satu kali selama proses berlangsung. Namun, penggantian filter hanya memperpanjang durasi kultur selama beberapa hari, setelah itu pengotoran yang signifikan akan terlihat dan batch harus dihentikan. Meskipun mengatasi masalah ini sangat penting untuk memaksimalkan kemampuan perfusi dan mempertahankan kontrol produksi yang konsisten, faktor-faktor yang menyebabkan pengotoran filter sebagian besar masih belum diketahui. Menyelidiki faktor-faktor ini merupakan tantangan karena sulitnya memodulasi faktor-faktor individual secara selektif dalam eksperimen perfusi sambil memastikan kinerja kultur sel dan sterilitas eksperimen.
Dalam studi ini, kami mengembangkan model skala kecil yang mensimulasikan pengaturan perfusi dan dapat memberikan data representatif tentang dampak faktor-faktor individual pada kinerja filter. Dengan menggunakan model offline ini, kami secara sistematis melakukan studi spiking menggunakan komponen-komponen individual dari kultur sel perfusi (fraksi pelet 10.000 g yang utamanya merupakan partikel dalam kisaran ukuran 200-1000 nm; fraksi pelet 100.000 g yang utamanya merupakan partikel dalam kisaran 50-200 nm; dan antibusa) dan menilai dampaknya pada pengotoran filter dan kecenderungan penyaringan produk.
Fraksi pelet 10.000 g dan fraksi pelet 100.000 g keduanya menunjukkan dampak yang bergantung pada konsentrasi pada kecenderungan pengotoran filter. Menariknya, mekanisme pengotoran tampaknya berbeda untuk kedua fraksi ini. Fraksi pelet 10.000 g tampaknya menyebabkan kombinasi pembentukan lapisan kue dan penyumbatan pori. Fraksi pelet 100.000 g terutama mungkin mendorong lebih banyak mekanisme berbasis penyumbatan pori. Untuk kedua fraksi ini, kami perlu menggunakan tingkat konsentrasi 2−4X untuk melihat kejadian pengotoran yang signifikan pada filter skala kecil saat dipacu secara individual.
Selama berlangsungnya studi ini, kami mengidentifikasi bahwa antibusa pada kenyataannya terakumulasi dalam jumlah yang sangat tinggi dalam kultur perfusi selama proses berlangsung. Dalam beberapa percobaan di mana sekitar 25 ppm antibusa ditambahkan setiap hari ke reaktor, antibusa yang setara dengan 250 ppm diukur pada Hari ke-21. Sangat menarik untuk dicatat bahwa bahkan dengan tingkat antibusa yang diukur sedemikian tinggi, busa yang signifikan terus diamati yang memerlukan penambahan lebih lanjut. Selain itu, kami juga melihat penurunan viabilitas dalam kultur. Meskipun tidak jelas apakah ini disebabkan oleh sensitivitas geser sel yang terpapar pada lingkungan geser tinggi dari perangkat retensi sel dalam kultur perfusi, ada kemungkinan juga bahwa tingkat antibusa yang tinggi dapat menjadi racun bagi sel (Flynn 2024 ; Routledge 2012 ). Dalam hal ini, kami mengamati bahwa di atas 50 ppm antibusa, ada pengurangan yang signifikan dalam pertumbuhan dan viabilitas sel (Informasi Pendukung S1: Gambar S9 ).
Studi literatur sejauh ini telah melaporkan efek partikel sekitar 200 nm yang menyebabkan pengotoran filter dan penyaringan produk. Sebagian besar studi telah menyoroti bahwa partikel-partikel ini terutama dapat menjadi sEV yang menyebabkan efek tersebut. Namun, pemisahan terutama bergantung pada metode berbasis ukuran seperti ultracentrifugasi. Antibusa memiliki distribusi ukuran partikel yang besar dengan partikel berkisar antara 50 nm hingga kurang dari 5 µm. Berdasarkan distribusi ukuran partikel ini, kemungkinan antibusa terdapat dalam fraksi pelet 10.000 g dan 100.000 g saat mengalami ultracentrifugasi. Kami mengukur kadar antibusa dalam fraksi ini dan menemukan bahwa memang terdapat dalam fraksi pelet 10.000 g dan 100.000 g .
Lonjakan antibusa dalam media biasa pada konsentrasi yang relevan menunjukkan efek pengotoran dan penyaringan produk yang bergantung pada konsentrasi yang signifikan. Untuk membedakan dampak vesikel ekstraseluler dan antibusa, kami merancang dan menjalankan pengaturan bioreaktor yang memungkinkan penambahan antibusa minimal. Sel dipertahankan pada viabilitas yang jauh lebih tinggi dibandingkan dengan kontrol yang menunjukkan bahwa antibusa mungkin sebenarnya menyebabkan sitotoksisitas seluler pada tingkat tinggi. Fraksi pelet 10.000 g dan 100.000 g dari uji “Tanpa antibusa” secara signifikan “lebih bersih,” dan tidak ada antibusa yang diukur dalam fraksi ini. Dalam studi lonjakan, fraksi pelet 10.000 g dan 100.000 g yang diperoleh dari kondisi “Tanpa antibusa” menunjukkan kecenderungan pengotoran filter yang lebih rendah dibandingkan dengan fraksi dari kondisi kontrol, yang selanjutnya menyoroti bahwa kadar antibusa yang tinggi yang digunakan dalam kultur perfusi dapat menyebabkan pengotoran filter. Perlu dicatat bahwa meskipun kinerja filter yang lebih baik diamati, kami mengamati retensi produk yang signifikan dalam kondisi “Tanpa antibusa” (Informasi Pendukung S1: Gambar S8 ). Ini menunjukkan bahwa faktor-faktor yang menyebabkan pengotoran dapat berbeda dari penyaringan yang dapat mencakup vesikel ekstraseluler, DNA, protein sel inang, dan sebagainya.
Faktor yang berbeda dapat berinteraksi secara berbeda dengan permukaan filter berdasarkan kimia filter. Kami menguji untuk melihat apakah antibusa alternatif menunjukkan efek pada kinerja filter. Dalam hal ini, Antibusa 204 tidak menunjukkan tanda-tanda pengotoran filter atau kecenderungan penyaringan produk. Namun, itu beracun bagi sel CHO (Informasi Pendukung S1: Gambar S9 ). Meskipun demikian, ini menyoroti bahwa strategi atau alternatif baru dapat dikembangkan untuk meningkatkan tantangan terkait kinerja filter dari kultur perfusi kepadatan sel tinggi.
Ini adalah studi pertama yang secara sistematis mempelajari dampak antibusa dalam kultur perfusi dan dampaknya terhadap pengotoran filter. Sementara studi ini difokuskan pada fraksi atau faktor individual dan kontribusi relatifnya terhadap kinerja filter, perlu dicatat bahwa faktor-faktor ini dapat berinteraksi satu sama lain atau sel, serpihan sel, dan komponen lain dan, pada gilirannya, memberikan efek yang berbeda pada kinerja filter. Studi lebih lanjut yang mengevaluasi dampak DNA dan efek kombinatorial diperlukan untuk mendapatkan wawasan mekanistik lebih lanjut. Pengetahuan ini dapat membantu kita membangun proses perfusi generasi berikutnya yang dapat lebih memanfaatkan potensi teknologi ini.



Leave a Reply