ABSTRAK
Akuakultur rumput laut tumbuh pesat secara global dan menawarkan manfaat lingkungan seperti mengurangi eutrofikasi dan meningkatkan keanekaragaman hayati. Swedia memiliki pantai yang panjang dengan kondisi yang baik untuk budidaya rumput laut, tetapi industri saat ini masih kecil. Selama dekade terakhir, beberapa proyek penelitian inovatif telah mengeksplorasi dan mengembangkan teknik yang disesuaikan dengan akuakultur rumput laut yang berkelanjutan. Studi ini mensintesis kemajuan terkini dalam penelitian akuakultur rumput laut Swedia, menyoroti inovasi yang mendukung hasil dan kualitas biomassa. Kami melakukan tinjauan sistematis terhadap 130 studi dari Thomson Reuters Web of Science, dengan fokus pada penelitian akuakultur rumput laut Swedia, dan akhirnya menyertakan 21 publikasi relevan dari tahun 1984 hingga 2025. Spesies rumput laut utama yang dibudidayakan di Swedia adalah rumput laut coklat Saccharina latissima dan rumput laut hijau Ulva fenestrata . Strategi utama untuk meningkatkan produktivitas, kualitas, dan keberlanjutan biomassa meliputi pengoptimalan persiapan juvenil berbasis darat, pemilihan lokasi budidaya yang cermat, dan pengaturan waktu panen berbasis laut yang strategis. Pendekatan inovatif seperti pemanfaatan air proses yang kaya nutrisi dari produksi pangan menawarkan metode berkelanjutan untuk meningkatkan hasil dan kandungan protein, menyelaraskan budidaya rumput laut dengan prinsip ekonomi sirkular. Pengembangan dan optimalisasi protokol budidaya di masa mendatang untuk spesies rumput laut kaya protein lainnya (misalnya, Palmaria palmata ) atau spesies yang toleran terhadap salinitas rendah (misalnya, Fucus vesiculosus atau U. intestinalis ) akan sangat penting untuk memaksimalkan potensi budidaya rumput laut Swedia, memastikan kontribusinya yang efektif terhadap ketahanan pangan dan konservasi lingkungan. Karena minat komersial terhadap rumput laut terus tumbuh, temuan yang dirangkum di sini memberikan dasar yang kuat untuk perluasan akuakultur rumput laut di Eropa dan sekitarnya.
1 Pendahuluan
Akuakultur rumput laut tumbuh dengan cepat dalam skala global, dan biomassa rumput laut memiliki penggunaan sumber daya terendah per ton protein yang dapat dimakan yang diproduksi dibandingkan dengan tanaman lain dan hewan ternak [ 1 ]. Budidaya rumput laut juga dapat memberikan manfaat lingkungan seperti remediasi perairan pesisir yang mengalami eutrofikasi [ 2 ] atau perairan proses industri makanan [ 3 ], dan biomassa yang dibudidayakan dapat digunakan untuk berbagai aplikasi termasuk makanan, pakan, dan biomaterial [ 4 ]. Selain itu, produktivitas komunitas rumput laut tinggi, terutama di daerah beriklim sedang dan kutub [ 5 ]. Beberapa spesies rumput laut, termasuk anggota genus Saccharina dan Ulva , dapat tumbuh pada tingkat produksi yang tinggi (misalnya, [ 6 , 7 ]) dan mengandung senyawa yang bernilai komersial (misalnya, protein, vitamin, zat gizi mikro, dan karbohidrat spesifik) [ 7 – 13 ], menjadikannya bahan baku yang menjanjikan untuk berbagai industri.
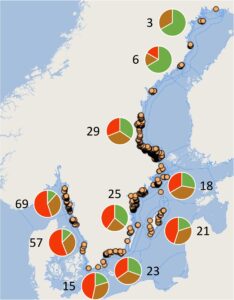
Akuakultur rumput laut masih sangat kecil di Swedia, meskipun pantainya panjang dengan air yang bersih dan relatif murni dan persepsi positif terhadap akuakultur rumput laut oleh masyarakat [ 14 ]. Kondisi pesisir di Swedia sebagian unik, dengan rentang pasang surut yang kecil, variasi spasial yang relatif besar dalam salinitas dan suhu, dan kepulauan yang luas yang menyediakan tempat berlindung bagi rumput laut dari kekuatan ekstrem paparan gelombang penuh di pantai yang lebih terbuka. Fitur-fitur ini memberikan tantangan tetapi juga peluang untuk budidaya rumput laut skala besar. Gradien salinitas yang besar di sepanjang garis pantai dari bagian timur laut Laut Baltik ke bagian barat laut Skagerrak (≈2–30 PSU) menghasilkan perubahan yang sesuai dalam kekayaan spesies flora laut. Keanekaragaman rumput laut di Laut Baltik payau relatif rendah, dan flora bentik didominasi oleh rumput laut hijau menuju Teluk Bothnia, sedangkan keanekaragamannya secara khas lebih tinggi di Skagerrak, di mana flora bentik didominasi oleh rumput laut merah dan coklat [ 15 ] (Gambar 1 ). Beberapa spesies rumput laut di Skagerrak menarik dari perspektif akuakultur dan industri [ 16 ] termasuk kelp ( Saccharina latissima , Laminaria digitata , dan L. hyperborea ) dan spesies hijau ( Ulva spp.) dan merah yang berharga ( Gracilaria spp., Chondrus crispus , Porphyra spp., dan Palmaria palmata ). Banyak dari spesies ini mengandung senyawa yang menarik secara komersial, dan beberapa dibudidayakan di bagian lain dunia [ 17 ]. Sementara kelp tidak ada di pantai timur Swedia, beberapa spesies Ulva (misalnya, U. intestinalis ) tumbuh subur di salinitas rendah yang ada di wilayah ini [ 18 ]. Spesies ini memiliki profil biokimia yang mirip dengan spesies tanaman Ulva yang dibudidayakan , seperti U. fenestrata [ 19 ]. Semua spesies ini memiliki potensi besar untuk sektor akuakultur rumput laut Swedia yang sedang berkembang pesat. Minat terhadap rumput laut sebagai makanan semakin meningkat di Swedia, dan spesies yang dibudidayakan meliputi S. latissima , L. digitata , Ulva spp., dan P. palmata [ 20 ]. Rumput laut dijual dalam keadaan segar atau diolah melalui pengeringan, blansing, pembekuan, atau fermentasi dan digunakan dalam makanan seperti rempah-rempah, roti, pesto, makanan ringan, sup, salad, pasta, dan smoothie, serta dalam suplemen makanan [ 20 ].
Selama dekade terakhir, beberapa proyek penelitian nasional telah memajukan akuakultur rumput laut Swedia. Proyek-proyek tersebut meliputi SEAFARM (2013–2017), yang mengeksplorasi potensi budidaya S. latissima dan L. digitata ; AquaAgriKelp (2014–2018), yang berfokus pada peningkatan budidaya rumput laut dan mendirikan peternakan rumput laut komersial pertama di Swedia; dan Sweaweed (2015–2020), yang berfokus pada budidaya U. fenestrata . Dua proyek, CirkAlg (2018–2021) dan BlueGreen (2021–2025), berfokus pada potensi rumput laut Swedia sebagai kontributor terhadap “pergeseran protein” dengan menghasilkan teknik budidaya sirkular dan metode pengolahan biomassa baru. Saat ini, proyek SenseAlg (2022–2025) dan Susweed (2023–2028) bertujuan untuk meningkatkan konsumsi rumput laut melalui pengembangan produk konsumen baru untuk pasar pangan dan melalui teknik budidaya yang lebih baik untuk U. fenestrata dan P. palmata . Tujuan dari tinjauan ini adalah untuk menyajikan ringkasan penelitian akuakultur rumput laut Swedia, dengan fokus pada produksi biomassa rumput laut dan kualitas serta kandungan biokimianya.
2 Metode
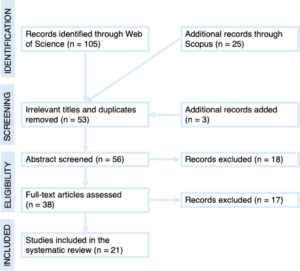
Kami menggunakan pendekatan tinjauan sistematis untuk mencari publikasi yang relevan secara objektif. Istilah pencariannya adalah “Swed* AND (macroalg* OR seaweed*) AND (cultiv* OR aquacult*) AND (growth* OR yield* OR protein* OR qualit*)”. Thomson Reuters Web of Science ditelusuri untuk semua literatur yang diterbitkan sebelum April 2024, dan total 130 studi diambil. Kriteria untuk memasukkan studi dalam tinjauan sistematis adalah bahwa penelitian (1) dilakukan di Swedia pada spesies asli Swedia, dan (2) ditujukan untuk mengoptimalkan hasil dan/atau kualitas biomassa rumput laut selama setiap tahap produksi. Studi yang hanya berfokus pada pemrosesan hilir biomassa rumput laut (misalnya, pengawetan, pemrosesan, ekstraksi, atau transformasi komponen biomassa tertentu) dikeluarkan dari tinjauan. Setelah menerapkan kriteria ini dan menyaring daftar referensi untuk makalah relevan tambahan, 21 publikasi antara tahun 1984 dan 2025 diambil untuk tinjauan sistematis (Gambar 2 ). Data (nilai rata-rata dan standar error of the mean [SEM] atau standar deviasi [SD] untuk berbagai perlakuan) diambil langsung dari tabel atau dari gambar menggunakan perangkat lunak gratis WebPlotDigitizer-4.2 [ 21 ] dan disajikan dalam Tabel 1 dan 2 .
| Sumber variasi | Tingkatan | Variabel dependen | Berarti | SEJARAH | % perubahan dibandingkan dengan | Referensi |
|---|---|---|---|---|---|---|
| Perawatan pengikat | Kontrol | Jumlah sporofit yang menetap cm −1 | 47.55 | 3.58 | 71 * | [ 22 ] |
| Perawatan | 27.84 | 2.40 | — | |||
| Waktu pra budidaya | 2 minggu | Berat (g) | 34.20 | 6.40 | — | [ 23 ] |
| 4/6 minggu | 57.20 | 5.20 | 67 * | |||
| Waktu penyebaran | September | Berat (g) | 167.80 | 30.80 | 135 * | |
| Oktober/November | pukul 71.30 | Jam 6.30 | — | |||
| September | Karbohidrat (mg g −1 dw) | 675.50 | 52.50 | 10 | ||
| Oktober/November | 616.50 | 39.80 | — | |||
| September | Asam lemak (mg g −1 dw) | 7.10 | 0.20 | 9 | ||
| Oktober/November | 6.50 | 0.10 | — | |||
| September | Protein (mg g −1 berat kering) | Tanggal 31.10 | 5.10 | — | ||
| Oktober/November | 47.50 | 6.50 | 53 * | |||
| Kedalaman budidaya | 2 juta | Berat (g) | 143.80 | 36.80 | 251 * | |
| 4 jam | 40.92 | 11.64 | — | |||
| 2 juta | Karbohidrat (mg g −1 dw) | Rp 717.000 | 65.00 | 29 * | ||
| 4 jam | 555.50 | 39.50 | — | |||
| 2 juta | Asam lemak (mg g −1 dw) | 6.90 | 0.20 | 1 | ||
| 4 jam | 6.80 | 0.20 | — | |||
| 2 juta | Protein (mg g −1 berat kering) | Jam 26.30 | 5.10 | — | ||
| 4 jam | 55.10 | 6.80 | 110 * | |||
| Area × paparan | Wilayah Utara/Tengah | Ukuran (g) | 5.47 | 0.54 | 206 * | [ 24 ] |
| Wilayah selatan | 1.79 | 0.21 | — | |||
| Daerah yang cukup terbuka/terlindungi | Ukuran (g) | 4.82 | 0.45 | 72 * | ||
| Area yang terekspos | 2.79 | 0.37 | — | |||
| Terpapar | Kandungan karbon jaringan (% dw) | 31.64 | 0.40 | 5 | ||
| Sedang/Terlindung | Tanggal 30.03 | 0.56 | — | |||
| Terpapar | Kandungan Nitrogen Jaringan (% dw) | 0,99 | 0,07 | -15 * | ||
| Sedang/Terlindung | 1.17 | 0,06 | — | |||
| Selatan Sedang/Terlindung | Biofouling (% luas wilayah) | 15.86 | 2.52 | 310 * | ||
| Sedang/Terlindung
Bagian utara/tengah terbuka |
3.87 | 0,93 | — | |||
| Penambahan nutrisi | Kontrol | Perpanjangan (mm d −1 ) | 17.95 | 1.34 | — | [ 25 ] |
| IMTA1 | Tanggal 24.10 | 1.76 | 34 * | |||
| Bahasa Indonesia: IMTA2 | 27.51 | 3.35 | 53 * | |||
| Kontrol | Kandungan Nitrogen Jaringan (% dw) | 0,70 | 0.10 | — | ||
| IMTA1 | 1.70 | 0,50 | 143 * | |||
| Bahasa Indonesia: IMTA2 | 2.10 | 0,50 | 200 * | |||
| Penambahan nutrisi | Kontrol | Laju pertumbuhan relatif (mm d −1 ) | 5.97 | 0,03 | [ 26 ] | |
| Diperlakukan | 5.90 | 0,04 | -1 | |||
| Kontrol | Biofouling (kelimpahan cm −2 ) | 6.97 | 0.76 | -43 * | ||
| Diperlakukan | 3,99 | 0,50 | — | |||
| Kontrol | Kandungan Nitrogen Jaringan (% dw) | 2.82 | 0.11 | 8 * | ||
| Diperlakukan | 3.04 | 0,09 | — | |||
| Penambahan nutrisi | Kontrol | Berat (kg/m) | 1.69 | 0.23 | — | [ 27 ] |
| Peternakan | 2.49 | 0.20 | 47 * | |||
| Kedalaman | 1 jam | Berat (kg/m) | 2.85 | 0.28 | 114 * | |
| 3 jam | 1.33 | 0,15 | — | |||
| 1 jam | Kandungan Nitrogen Jaringan (% dw) | 1.67 | 0.13 | 13 * | ||
| 3 jam | 1.48 | 0.10 | — | |||
| Nutrisi × kedalaman | Kontrol 1 m | Cakupan epifit (% area) | 14.83 | 4.08 | 59 * | |
| Pertanian 1 m | 6.12 | 2.24 | — | |||
| Kontrol 3 m | Cakupan epifit (% area) | 5.58 | 1.77 | 63 * | ||
| Pertanian 3 m | 2.04 | 1.36 | — | |||
| Paparan | Kärringön (area yang terbuka) | Berat basah (g) | 31.94 | 2.21 | 206 * | [ 28 ] |
| Daerah lain yang lebih terlindungi | pukul 10.45 | 3.95 | — |
* Menunjukkan perubahan signifikan secara statistik ( p < 0,05).
| Sumber variasi | Tingkatan | Variabel | Berarti | SEJARAH | % perubahan dibandingkan dengan | Referensi |
|---|---|---|---|---|---|---|
| Fase riwayat hidup | Gametofit rekombinan | Panjang (mm) | 4.34 | 1.26 | 54 * | [ 29 ] |
| Gametofit klonal | 2.81 | 0.54 | — | |||
| Gametofit rekombinan | Protein kasar (% dw) | 22.67 | 0.67 | 22 * | ||
| Gametofit klonal | 18.51 | 0.48 | — | |||
| Gametofit rekombinan | Asam lemak (% dw) | 2.27 | 0,06 | 3 * | ||
| Gametofit klonal | 2.21 | 0,04 | — | |||
| Gametofit rekombinan | Pigmen (% berat kering) | 0.34 | 0,02 | 19 * | ||
| Gametofit klonal | 0.28 | 0,02 | — | |||
| Gametofit rekombinan | Karbohidrat (% dw) | 21.91 | 0.43 | — | ||
| Gametofit klonal | 22.37 | 0.66 | 2 | |||
| Kepadatan kawanan | Tinggi | Hasil (g dw m −1 ) | Tanggal 31.05 | 4.42 | 474 * | [ 30 ] |
| Rendah | 5.41 | 2.19 | — | |||
| Waktu panen | April | Hasil (g dw m −1 ) | 48.34 | 3.44 | -80 * | [ 31 ] |
| Awal Mei | 115.17 | 3.51 | -53 * | |||
| Akhir Mei | 243.13 | 3.89 | — | |||
| Awal Juni | 194.79 | 5.29 | -20 | |||
| Pertengahan Juni | 136.49 | 5.01 | -44 * | |||
| April | Protein kasar (% dw) | 20.55 | 0.66 | — | ||
| Awal Mei | 7.12 | 0.30 | -65 * | |||
| Akhir Mei | 7.12 | 0.35 | -65 * | |||
| Awal Juni | 5.83 | 0.35 | -72 * | |||
| Pertengahan Juni | 4.72 | 0.43 | -77 * | |||
| Waktu panen | April | Asam lemak (% dw) | 20.56 | 0.72 | — | |
| Awal Mei | 3.89 | 0,94 | -81 * | |||
| Akhir Mei | 7.44 | 0,88 | -64 * | |||
| Awal Juni | 6.67 | 1.37 | -68 * | |||
| Pertengahan Juni | 6.78 | 1.33 | -67 * | |||
| Waktu panen | April | Pigmen (mg g −1 ) | 40.9 | 0.32 | — | |
| Awal Mei | 36 | 0,93 | -12 * | |||
| Akhir Mei | 32.1 | 0.48 | -22 * | |||
| Awal Juni | 28 | 0,58 | -32 * | |||
| Pertengahan Juni | 23.8 | 0.71 | -42 * | |||
| April | Karbohidrat (% dw) | 32.10 | 1.27 | -20 * | ||
| Awal Mei | 33.43 | 0,94 | -17 * | |||
| Akhir Mei | pukul 29.45 | 2.03 | -26 * | |||
| Awal Juni | 38.73 | 1.67 | -3 | |||
| Pertengahan Juni | 40.06 | 0,77 | — | |||
| Iradiasi | 50 μmol foton m −2 s−1 | Tingkat pertumbuhan (% hari -1 ) | 22.53 | 0,89 | — | [ 32 ] |
| 100 μmol foton m −2 s −1 | tanggal 26.08 | 0.76 | 16 * | |||
| 160 μmol foton m −2 s −1 | Tanggal 25.19 | 1.27 | 12 * | |||
| Suhu | 13 derajat celcius | Tingkat pertumbuhan (% hari -1 ) | 25.95 | 0.38 | 11 * | |
| 18 derajat celcius | Tanggal 23.29 | 1.01 | — | |||
| Iradiasi | 50 μmol foton m −2 s −1 | Asam lemak (% dw) | 1.43 | 0,05 | — | |
| 100 μmol foton m −2 s −1 | 1.29 | 0,03 | -9 * | |||
| 160 μmol foton m −2 s −1 | 1.21 | 0,05 | -15 * | |||
| Suhu | 13 derajat celcius | Asam lemak (% dw) | 1.20 | 0,03 | -16 * | |
| 18 derajat celcius | 1.43 | 0,02 | — | |||
| Nitrogen | < 5 μmol L −1 NO3 − | Asam lemak (% dw) | 1.32 | 0,02 | — | |
| 150 μmol L −1 NO3 − | 1.73 | 0,05 | 31 * | |||
| 500 μmol L −1 NO3− | 1.79 | 0,02 | 35 * | |||
| Iradiasi | 50 μmol foton m −2 s −1 | Protein kasar (% dw) | 9.46 | 0,50 | — | |
| 100 μmol foton m −2 s −1 | 7.97 | 0.41 | -16 * | |||
| 160 μmol foton m −2 s −1 | 6.89 | 0.41 | -27 * | |||
| Suhu | 13 derajat celcius | Protein kasar (% dw) | 9.13 | 0.41 | 31 * | |
| 18 derajat celcius | 6.97 | 0.33 | — | |||
| Nitrogen | < 5 μmol L −1 NO3 − | Protein kasar (% dw) | 5.15 | 0.17 | — | |
| 150 μmol L −1 NO3 − | tanggal 15.06 | 0.54 | 193 * | |||
| 500 μmol L −1 NO3− | 16.89 | 0.34 | 228 * | |||
| Iradiasi | 50 μmol foton m −2 s −1 | Fenolik (% berat kering) | 0.13 | 0.00 | — | |
| 100 μmol foton m −2 s −1 | 0.13 | 0.00 | -6 | |||
| 160 μmol foton m −2 s −1 | 0.11 | 0.00 | -19 * | |||
| Nitrogen | < 5 μmol L −1 NO3 − | Fenolik (% berat kering) | 0,15 | 0,01 | — | |
| 150 μmol L −1 NO3 − | 0.23 | 0,01 | 51 * | |||
| 500 μmol L −1 NO3− | 0.23 | 0,01 | 47 * | |||
| Suhu | 13 derajat celcius | Karbohidrat (% dw) | 33.90 | 0.63 | -10 * | [ 33 ] |
| 18 derajat celcius | 37.69 | 0,65 | — | |||
| Nitrogen | < 5 μM NO3 − | Karbohidrat (% dw) | 31.44 | 1.42 | — | |
| 150 μM NO3 − | 27.24 | 1.18 | -13 * | |||
| 500 μM NO3 − | 26.71 | 1.88 | -15 * | |||
| HPPW (Hyper Power Plant) | Kontrol air laut (28 hari) | Berat segar (g) | 6.17 | 0.20 | — | [ 34 ] |
| SAL (28 hari) | 27.26 | 0,70 | 342 * | |||
| TUB (28 hari) | 37.11 | 1,99 | 502 * | |||
| Kontrol air laut (14 hari) | Berat segar (g) | 9.80 | 0,98 | — | ||
| SAL (14 hari) | 16.57 | 1.27 | 69 * | |||
| TUB (14 hari) | 18.24 | 1.13 | 86 * | |||
| Kontrol air laut (28 hari) | Protein kasar (% dw) | 12.90 | 0.24 | — | ||
| SAL (28 hari) | 33.39 | 0.81 | 159 * | |||
| TUB (28 hari) | 31.77 | 0.48 | 146 * | |||
| Kontrol air laut (14 hari) | Protein kasar (% dw) | 8.39 | 0.32 | — | ||
| SAL (14 hari) | 29.84 | 0.48 | 256 * | |||
| TUB (14 hari) | 30.24 | 0.24 | 261 * | |||
| HPPW (Hyper Power Plant) | Kontrol | Berat segar (g) | 164 | 7.33 | — | [ 35 ] |
| GARAM | 230 | 1.33 | 40 * | |||
| BAK MANDI | 214 | 4.00 | 30 * | |||
| Kontrol | Protein kasar (% dw) | 2.88 | 0.10 | — | ||
| GARAM | Tanggal 12.02 | 0,50 | 320 * | |||
| BAK MANDI | 16.94 | 0.35 | 488 * | |||
| HPPW (Hyper Power Plant) | Kontrol (PES) | Berat segar (g) | 614.79 | 1.21 | — | [ 36 ] |
| BAK MANDI | 600.82 | 4.25 | 2 * | |||
| Awal | Protein kasar (% dw) | 21.80 | 0.17 | — | ||
| Kontrol (PES) | 26.80 | 0.29 | 23 * | |||
| BAK MANDI | 37.40 | 1.04 | 72 * |
* Menunjukkan perubahan signifikan secara statistik ( p < 0,05).
3 Hasil
Publikasi yang diambil terutama difokuskan pada spesies rumput laut coklat S. latissima dan spesies rumput laut hijau U. fenestrata dan pada pemeliharaan juvenil dan dewasa rumput laut dalam sistem budidaya darat dan laut (Gambar 3 ). Topik penelitian meliputi optimalisasi kondisi budidaya, faktor temporal dan spasial yang mempengaruhi hasil dan kualitas biomassa, dan perlakuan yang ditujukan pada peningkatan ketersediaan nutrisi yang berkelanjutan (Gambar 3 ). Kandungan protein dan nitrogen berkorelasi dalam rumput laut [ 37 ] dan dalam semua makalah yang ditinjau, kandungan protein kasar dihitung dari kandungan nitrogen jaringan dengan faktor konversi lima [ 37 ].

3.1 Budidaya Perairan Saccharina latissima
Saccharina latissima (Linnaeus) CE Lane, C. Mayes, Druehl dan GW Saunders 2006, adalah spesies rumput laut air dingin yang dapat ditemukan di sepanjang pantai barat Swedia tetapi tidak ada di Laut Baltik karena kebutuhan salinitas lautnya yang lebih tinggi [ 38 ]. Ia tumbuh di pantai berbatu yang relatif terlindung hingga terbuka di mana ia dapat membentuk hutan bawah air yang luas yang menyediakan tempat berlindung dan makanan bagi banyak organisme terkait [ 39 ]. Saccharina latissima dibudidayakan secara komersial di beberapa negara Eropa utara (misalnya, Kepulauan Faroe, Denmark, Norwegia) [ 40 – 42 ]. Seperti spesies rumput laut lain dari genus Laminariales, S. latissima memiliki siklus hidup haplodiplontik, heteromorfik dengan gametofit haploid uniseriat mikroskopis, bercabang, dengan pertumbuhan apikal dan sporofit diploid parenkim foliosa makroskopis dengan pertumbuhan interkalar [ 43 ].
3.1.1 Penyemaian dan Pra-Budidaya Benih
Budidaya S. latissima dibagi menjadi dua fase: fase berbasis daratan, di mana sporofit muda dipersiapkan, dan fase berbasis laut, di mana juvenil dipindahkan ke lokasi budidaya berbasis laut untuk tumbuh menjadi dewasa. Persiapan sporofit muda melibatkan berbagai langkah [ 22 – 24 ]. Di Swedia, sporofit dewasa yang tidak subur dikumpulkan dari ladang pada musim panas atau awal musim gugur (Juni hingga Agustus). Kesuburan diinduksi dengan memotong lamina sekitar 15–20 cm di atas meristem interkalar, diikuti oleh inkubasi dalam medium Provasoli setengah kekuatan (PES) [ 44 ] pada 10°C dalam cahaya putih (≈ 100 μmol foton m −2 s −1 ) dan kondisi hari pendek (8 jam terang:16 jam gelap). Setelah 5–10 minggu, jaringan sorus yang fertil dibedah dan disimpan semalaman di handuk kertas basah pada suhu 10°C untuk menginduksi pelepasan zoospora. Setelah perendaman dalam air laut, zoospora yang dilepaskan berkembang menjadi gametofit yang dapat tumbuh secara vegetatif selama > 6 bulan jika disimpan dalam labu berudara pada suhu 12°C dalam kondisi cahaya merah dan hari panjang (16 jam terang: 8 jam gelap) [ 22 – 24 ]. Lebih jauh, gametofit dapat dikriopreservasi untuk penyimpanan jangka panjang menggunakan berbagai kombinasi metode pendinginan dan krioprotektan [ 45 ]. Pelepasan gamet dan fertilisasi diinduksi dengan mentransfer gametofit ke cahaya putih (35–70 μmol foton m −2 s −1 ) dan kondisi hari panjang (16 jam terang: 8 jam gelap). Sporofit muda yang dihasilkan disemai untuk ditanam di lokasi budidaya laut dengan membiarkan zoospora/gametofit menempel dan matang selama beberapa minggu atau bulan pada benang tipis di kultur tangki [ 22 – 24 ].
Persiapan juvenil membutuhkan banyak energi dan tenaga kerja, dan dari sudut pandang ekonomis diinginkan untuk meminimalkan waktu yang dihabiskan juvenil dalam kultur tangki. Untuk menyederhanakan proses penyemaian, spora, gametofit, atau sporofit juvenil dapat diaplikasikan ke tali menggunakan berbagai perlakuan pengikat [ 46 ]. Pengikat (biasanya hidrokoloid) memungkinkan adhesi in situ gametofit mikroskopis dan sporofit embrionik (atau campuran keduanya) ke substrat dan memungkinkan pemindahan langsung ke budidaya berbasis laut tanpa pra-budidaya dalam kultur tangki berbasis darat. Visch et al. [ 22 ] menerapkan dua perlakuan pengikat yang berbeda (agar dan k -karagenan) dan prosedur aplikasi (gametofit ditambahkan di atas pengikat atau dicampur dengan pengikat) untuk menyelidiki apakah prosedur ini cocok untuk S. latissima Swedia . Perlakuan pengikat mengurangi jumlah sporofit yang bertahan hidup terlepas dari metode aplikasi [ 22 ] (Tabel 1 ). Pada kecepatan aliran 0,5 cm s −1 , 71% lebih banyak sporofit muda ditemukan pada kontrol tanpa perlakuan pengikat, yang menunjukkan bahwa perlakuan pengikat yang diuji tidak efektif untuk S. latissima Swedia [ 22 ] (Tabel 1 ). Namun, hasil ini harus ditafsirkan dengan hati-hati karena berasal dari satu studi.
Cara lain untuk mengurangi biaya yang terkait dengan persiapan juvenil adalah dengan mengurangi waktu pra-budidaya juvenil. Thomas et al. [ 23 ] menyelidiki efek waktu pra-budidaya juvenil dan pengaturan waktu penyebaran pada ukuran sporofit S. latissima dewasa dan kandungan biokimia saat panen. Juvenil dikembangkan dari spora dan dibudidayakan terlebih dahulu selama 2, 4, atau 6 minggu di tangki darat dan disebarkan pada bulan September, Oktober, atau November di lokasi pertanian laut yang sama. Semua rumput laut dipanen pada akhir Mei. Sporofit dewasa yang dibudidayakan terlebih dahulu selama 4 dan 6 minggu memiliki berat basah 67% lebih besar dibandingkan dengan sporofit yang dibudidayakan terlebih dahulu selama 2 minggu [ 23 ] (Tabel 1 ). Lebih jauh lagi, sporofit yang disebarkan pada awal musim gugur (September) 135% lebih berat dan memiliki total karbohidrat 10% lebih tinggi dan kandungan asam lemak 9% lebih tinggi dibandingkan dengan sporofit yang disebarkan pada bulan Oktober dan November [ 23 ] (Tabel 1 ). Namun, kandungan protein 53% lebih tinggi pada sporofit yang disebarkan pada akhir November dibandingkan dengan September [ 23 ]. Hasil-hasil ini mengindikasikan bahwa periode pra-budidaya berbasis lahan untuk juvenil selama minimal 4 minggu diperlukan untuk hasil yang optimal dan bahwa waktu penyebaran penting untuk hasil dan kandungan biokimia dari sporofit S. latissima dewasa . Namun, ukuran pada saat panen dan kandungan biokimia bervariasi pada skala spasial yang berbeda, dari tali budidaya replikasi ke lokasi budidaya yang berbeda [ 23 ], yang mengindikasikan bahwa pemilihan lokasi juga penting dalam akuakultur S. latissima .
3.1.2 Pemilihan Spasial Lokasi Budidaya yang Optimal
Pemilihan lokasi budidaya yang cocok sangat penting untuk mengoptimalkan hasil S. latissima saat panen. Faktor lingkungan seperti ketersediaan cahaya dan nutrisi, salinitas, suhu, dan paparan gelombang memengaruhi pertumbuhan sporofit dan bervariasi di seluruh skala spasial. Thomas et al. [ 23 ] menemukan bahwa kedalaman budidaya (2 m vs. 4 m) secara signifikan memengaruhi ukuran sporofit saat panen. Sporofit yang tumbuh pada kedalaman 2 m 251% lebih berat dibandingkan dengan sporofit yang tumbuh pada kedalaman 4 m [ 23 ] (Tabel 1 ), kemungkinan karena ketersediaan cahaya yang lebih besar pada kedalaman 2 m. Sementara kandungan asam lemak total tetap konsisten di antara kedalaman, sporofit pada kedalaman 2 m memiliki kandungan karbohidrat total 29% lebih tinggi, sedangkan sporofit pada kedalaman 4 m menunjukkan kandungan protein total 110% lebih tinggi [ 23 ] (Tabel 1 ).
Visch et al. [ 24 ] selanjutnya menyelidiki variasi dalam pertumbuhan, kandungan karbon dan nitrogen, dan biofouling S. latissima pada skala spasial yang berbeda dan tiga tingkat paparan gelombang sepanjang ~400 km pantai barat Swedia [ 24 ]. Meskipun konsentrasi nutrisi rata-rata, iradiasi, salinitas, dan suhu serupa di seluruh wilayah, variasi pertumbuhan yang signifikan diamati pada semua skala spasial, dari tali duplikat berjarak 20 m hingga wilayah yang terpisah sejauh 20 km. Secara keseluruhan, sporofit yang tumbuh di wilayah utara/tengah 206% lebih besar daripada rumput laut yang tumbuh di wilayah selatan, dan sporofit yang tumbuh di daerah yang cukup terbuka/terlindung 72% lebih besar dibandingkan dengan rumput laut yang tumbuh di daerah yang terbuka [ 24 ] (Tabel 1 ). Kandungan karbon 5% lebih tinggi, dan kandungan nitrogen 15% lebih rendah, pada rumput laut yang tumbuh di lokasi yang terbuka dibandingkan dengan lokasi yang cukup terbuka/terlindung. Selain itu, biofouling 310% lebih tinggi di lokasi yang cukup terbuka/terlindung di wilayah paling selatan dibandingkan dengan wilayah utara/tengah dan lokasi yang terbuka [ 24 ] (Tabel 1 ).
3.1.3 Nutrisi Tambahan—Budidaya Bersama dengan Bivalvia
Akuakultur multi-trofik terpadu (IMTA) menggabungkan spesies dari berbagai tingkat trofik untuk memanfaatkan kelebihan nutrisi dan mencegah degradasi lingkungan [ 47 , 48 ]. Spesies ekstraktif seperti bivalvia dan rumput laut sering dimasukkan dalam sistem ini untuk membersihkan partikel dan nutrisi terlarut dari akuakultur yang diberi pakan seperti ikan sirip atau krustasea [ 49 , 50 ]. Bahkan tanpa spesies yang diberi pakan, mengintegrasikan rumput laut dengan bivalvia dapat membantu mengurangi beban nutrisi lokal [ 27 ] dan meningkatkan kualitas rumput laut karena bivalvia mengeluarkan limbah metabolismenya sendiri [ 51 ] dan berpotensi mengurangi organisme pengotor karena kapasitas penyaringannya [ 26 , 27 ].
Efek dari penambahan nutrisi pada pertumbuhan S. latissima diuji di tangki luar ruangan, menggunakan nutrisi buatan dan limbah kerang biru ( Mytilus edulis ) [ 25 ]. Konsentrasi dan komposisi nutrisi buatan dipilih untuk meniru limbah dari peternakan ikan sirip (IMTA1, rata-rata 2,73, 3,2, dan 0,07 μmol L −1 amonium, nitrat, dan fosfat), dan kerang ditambahkan untuk mempelajari efek gabungan nutrisi yang dilepaskan dari pengaturan IMTA dengan ikan dan bivalvia (IMTA2, rata-rata 3,11, 2,66, dan 0,13 μmol L −1 amonium, nitrat, dan fosfat, masing-masing). Penambahan nutrisi yang relatif sederhana dibandingkan dengan kontrol (rata-rata 1,14, 0,36, dan 0,08 μmol L −1 amonium, nitrat, dan fosfat, berturut-turut) menghasilkan pertumbuhan 34%–53% lebih banyak dalam hal pemanjangan dan 143%–200% kandungan nitrogen total yang lebih tinggi pada sporofit S. latissima berumur satu tahun [ 25 ] (Tabel 1 ). Sebaliknya, tidak ada perbedaan pertumbuhan yang signifikan diamati ketika membudidayakan bersama sporofit S. latissima dengan bivalvia saja (kerang biru dan tiram, Magallana gigas ) dalam eksperimen budidaya tangki yang serupa (Tabel 1 ) [ 26 ]. Peningkatan nutrisi relatif pada perlakuan bivalvia lebih rendah (rata-rata 4,4 dan 0,64, 5,5 dan 0,73, dan 4,9 dan 0,72 μmol L −1 amonium dan fosfat masing-masing pada perlakuan kontrol, kerang biru, dan tiram) dibandingkan dengan efek perlakuan dalam penelitian oleh Rugiu et al. [ 25 ]. Namun, perlakuan bivalvia menurunkan biofouling hingga 43% dan meningkatkan kandungan nitrogen hingga 8% pada sporofit yang diberi perlakuan dibandingkan dengan kontrol yang hanya menerima air laut [ 26 ] (Tabel 1 ).
Percobaan yang dijelaskan di atas dilakukan di sistem tangki luar ruangan dan mungkin telah melebih-lebihkan efek bivalvia pada rumput laut karena tidak ada pengenceran nutrisi dari gelombang atau arus. Dalam pengaturan lapangan, nutrisi dari peternakan ikan sirip biasanya diencerkan ke konsentrasi latar belakang dalam jarak 200 m dari peternakan [ 52 , 53 ]. Lebih jauh lagi, kapasitas bivalvia untuk menghilangkan propagul biofouling juga dapat dilebih-lebihkan karena sebagian besar air melewati “filter” bivalvia. Hargrave et al. [ 27 ] menyelidiki co-budidaya terintegrasi dengan menyebarkan S. latissima pada kedalaman 1 dan 3 m di peternakan kerang biru skala komersial di pantai barat Swedia [ 27 ]. Mereka menemukan hasil 47% lebih tinggi dari rumput laut yang dibudidayakan di dekat peternakan kerang dibandingkan dengan lokasi kontrol 500 m di hulu dari lokasi peternakan, dan rumput laut pada kedalaman 1 m tumbuh 114% lebih banyak dibandingkan dengan 3 m [ 27 ] (Tabel 1 ). Kandungan nitrogen rumput laut tidak terpengaruh oleh kedekatan dengan peternakan, tetapi rumput laut pada kedalaman 1 m memiliki kandungan nitrogen 13% lebih tinggi dibandingkan dengan yang berada di 3 m [ 27 ]. Lebih jauh lagi, biofouling pada lamina rumput laut berkurang sebesar 59% dan 63% pada kedalaman 1 dan 3 m di dekat peternakan [ 27 ] (Tabel 1 ). Karena biofouling dan keterbatasan nutrisi umumnya dibahas sebagai masalah dalam akuakultur rumput laut [ 54 ], hasil ini menunjukkan manfaat tambahan dari co-budidaya rumput laut dan kerang biru di luar penambahan nutrisi.
Ko-budidaya dapat menjadi tantangan ketika spesies memiliki persyaratan lingkungan dan optima yang berbeda untuk pertumbuhan. Misalnya, remis biru membutuhkan ketersediaan fitoplankton yang tinggi dan dapat mentolerir berbagai suhu dan salinitas [ 55 ]. Di sisi lain, rumput laut lebih menyukai area yang kaya nutrisi terlarut, dengan lebih sedikit material yang tersuspensi dan ketersediaan cahaya yang cukup dan biasanya tidak toleran terhadap kondisi suhu dan salinitas yang berfluktuasi [ 56 , 57 ]. Visch et al. [ 28 ] menyelidiki perbedaan pertumbuhan spasial dan kapasitas mitigasi nutrisi S. latissima dan remis biru pada skala mulai dari 500 m hingga lebih dari 50 km dalam sistem fjord Swedia. Mereka menemukan bahwa kondisi optimum untuk pertumbuhan S. latissima dan remis biru berbeda, dengan pertumbuhan rumput laut 206% lebih tinggi di area luar yang relatif terbuka, sementara area dalam yang relatif terlindung mendukung pertumbuhan remis biru [ 28 ] (Tabel 1 ). Hasil-hasil ini dengan jelas memperlihatkan pentingnya pemilihan lokasi yang cermat ketika mempertimbangkan budidaya bersama berbagai spesies secara bersamaan dalam pengaturan IMTA, dibandingkan dengan monokultur.
3.2 Ulva fenestrata Akuakultur
Ulva fenestrata Postels dan Ruprecht 1840, adalah spesies laut yang ditemukan di sepanjang pantai Skagerrak Swedia hingga selat Denmark tetapi tidak ada di Laut Baltik [ 58 ]. Tumbuh hingga kedalaman sekitar 0,5 m menempel pada batu atau sebagai epifit pada rumput laut lainnya. Ulva fenestrata memiliki siklus hidup haplodiplontik, isomorfik dengan generasi gametofit dan sporofit makroskopis yang identik [ 43 ]. Gametofit haploid bersifat rekombinan dan berasal dari zoid haploid atau klonal dan berasal dari gamet yang tidak kawin [ 59 ]. Pembentukan dan pelepasan swarmer (gamet dan zoid) dikendalikan oleh inhibitor yang berbeda dan dapat diinduksi jika ini dihilangkan [ 59 ]. Anggota Ulva berdaun daun , seperti U. fenestrata , menunjukkan potensi sebagai kultur yang mengapung bebas di tangki, bioreaktor, cekungan, atau kolam [ 32 , 60 – 62 ].
3.2.1 Pra-Budidaya Benih—Kepadatan Penanaman, Suhu, dan Ketersediaan Nutrisi
Ulva fenestrata dapat dibudidayakan dengan perbanyakan vegetatif dalam kultur tangki berbasis darat atau pada long-line berbiji di laut terbuka. Dalam kasus terakhir, teknik budidaya menyerupai S. latissima dalam hal fase penyemaian dan pra-budidaya berbasis darat dan fase pertumbuhan berbasis laut diperlukan. Untuk mengoptimalkan kondisi dalam fase pra-budidaya, perkembangan ontogenetik awal gamet dan zoid yang tidak kawin dibudidayakan pada kepadatan yang berbeda (500, 5000, dan 10.000 kawanan mL −1 ) dan terkena suhu yang berbeda (10°C dan 15°C) dan kondisi nutrisi (PES atau media 3xPES) [ 44 ] dipelajari [ 29 ]. Lebih lanjut, profil biokimia dari gametofit rekombinan dan klonal yang dihasilkan dibandingkan setelah 12 minggu pra-budidaya dalam kultur tangki. Kepadatan dan suhu swarmer memiliki efek yang relatif kecil pada pertumbuhan dan kandungan biokimia U. fenestrata muda , tetapi penambahan nutrisi diperlukan untuk perkembangan normal di semua perlakuan. Gametofit rekombinan memiliki perkembangan ontogenetik yang lebih cepat, laju pertumbuhan 54% lebih tinggi dalam hal panjang, dan mengandung 22% lebih banyak protein kasar, 3% lebih banyak asam lemak, dan 19% lebih banyak pigmen dibandingkan dengan gametofit klonal [ 29 ] (Tabel 2 ). Kandungan karbohidrat serupa di antara fase-fase riwayat hidup yang berbeda, dengan gametofit klonal memiliki, rata-rata, kandungan karbohidrat 2% lebih tinggi [ 29 ] (Tabel 2 ).
Dalam percobaan terpisah, gametofit klonal U. fenestrata disemai pada benang dengan kepadatan berbeda (500 dan 10.000 swarmer mL −1 ) dan diekspos ke berbagai suhu (10°C dan 15°C) dan kondisi nutrisi (PES atau 3xPES) selama 6 minggu dalam fase pra-budidaya berbasis daratan [ 30 ]. Gametofit juvenil yang diperlakukan berbeda kemudian dipindahkan ke lokasi budidaya berbasis laut dan dibiarkan tumbuh selama 6 bulan (Oktober hingga April). Saat panen, hasil U. fenestrata dewasa yang disemai dengan kepadatan swarmer tinggi adalah 474% lebih tinggi dibandingkan dengan hasil rumput laut yang disemai dengan kepadatan rendah [ 30 ] (Tabel 2 ), mungkin karena ketahanan yang lebih baik terhadap pengotoran dan pertumbuhan berlebih. Namun, penambahan nutrisi dan suhu selama fase pra-budidaya hanya memiliki efek minor pada hasil U. fenestrata dewasa yang tumbuh di laut. Lebih jauh lagi, semua perlakuan yang diterapkan selama fase pra-budidaya hanya memiliki efek minor pada kandungan biokimia gametofit U. fenestrata dewasa [ 30 ]. Kandungan biokimia berada dalam kisaran 16,6%–20,7% berat kering (dw) untuk protein kasar, 3,2%–3,6% dw untuk total asam lemak, 25,7%–29,7% dw untuk total karbohidrat, 2,5%–3,8% dw untuk total pigmen, dan 0,2%–0,3% dw untuk total fenolik [ 30 ]. Hasil-hasil ini menunjukkan bahwa penambahan nutrisi diperlukan untuk perkembangan normal U. fenestrata dalam fase pra-budidaya dan bahwa penyemaian dengan kepadatan kawanan yang tinggi menghasilkan hasil panen yang lebih tinggi. Namun, kondisi lingkungan (suhu dan nutrisi) selama fase pra-budidaya memiliki pengaruh kecil terhadap hasil dan kualitas rumput laut dewasa.
3.2.2 Waktu Panen
Hasil dan kualitas biomassa diselidiki lebih lanjut dalam percobaan budidaya skala besar (2 ha) di mana U. fenestrata dipanen pada titik waktu yang berbeda [ 31 ]. Juvenil ditanam dengan kepadatan tinggi (10.000 kawanan mL −1 ), dibudidayakan terlebih dahulu selama 6 minggu pada suhu 15°C dengan penambahan nutrisi (media PES kekuatan normal) [ 44 ], dan dipindahkan ke lokasi pertanian pada musim gugur (Oktober). Hasil biomassa, biofouling, dan kandungan biokimia ditentukan pada tanggal panen yang berbeda (dimulai awal April dan berlanjut hingga pertengahan Juni). Waktu panen memengaruhi sebagian besar variabel yang diukur. Hasil biomassa tertinggi pada akhir Mei; antara 25% dan 403% lebih tinggi daripada tanggal panen yang lebih awal atau lebih lambat [ 31 ] (Tabel 2 ). Kualitas biomassa dalam hal kandungan protein kasar, asam lemak, dan pigmen (Chl a dan b ) adalah antara 189%–335%, 176%–429%, dan 14%–72% lebih tinggi pada awal April dibandingkan dengan tanggal panen selanjutnya [ 31 ] (Tabel 2 ). Total karbohidrat meningkat sedikit pada akhir musim panen (pertengahan Juni) dan antara 3% dan 36% lebih tinggi daripada tanggal panen sebelumnya [ 31 ] (Tabel 2 ). Studi ini dengan jelas menunjukkan bahwa ada trade-off antara kualitas biomassa dan hasil (yaitu, kualitas lebih tinggi di awal tetapi hasil lebih tinggi di akhir musim) dan bahwa waktu panen U. fenestrata sangat bergantung pada aplikasi hilir biomassa (misalnya, makanan atau biomaterial).
3.2.3 Mengoptimalkan Hasil dan Kualitas Biomassa dalam Kultur Tangki
Keuntungan budidaya tangki dalam ruangan adalah bahwa faktor lingkungan seperti cahaya, suhu, nutrisi, dan CO 2 dapat dimanipulasi untuk memaksimalkan hasil atau kandungan biokimia yang diinginkan (seperti protein, lipid atau karbohidrat) [ 32 , 33 ]. Berbagai faktor lingkungan yang berkontribusi terhadap pertumbuhan dan kualitas U. fenestrata diuji dalam serangkaian eksperimen multifaktorial yang memanipulasi tingkat iradiasi, suhu, nutrisi (nitrat dan fosfat), dan CO 2 [ 32 , 33 ]. Rumput laut memiliki laju pertumbuhan 16% lebih tinggi pada ≥ 100 μmol foton m −2 s −1 dibandingkan dengan 50 μmol foton m −2 s −1 , dan laju pertumbuhan 11% lebih tinggi pada 11 ° C dibandingkan dengan 18 ° C [ 62 ] (Tabel 2 ). Anehnya, baik penambahan nutrisi (150 atau 500 μmol L −1 nitrat dan/atau 50 μmol L −1 fosfat) maupun CO 2 (2500 ppm) tidak meningkatkan hasil U. fenestrata , mungkin karena induksi fertilitas dan pelepasan swarmer [ 32 ]. Untuk menguatkan hasil ini, pertumbuhan U. fenestrata tidak terpengaruh oleh penambahan nutrisi (media PES atau 3xPES), tetapi fertilitas 29% lebih tinggi pada perlakuan nutrisi dibandingkan dengan kontrol [ 63 ]. Namun, ada trade-off dalam hal pertumbuhan dan kualitas biomassa, karena iradiasi tinggi dan sedang menghasilkan asam lemak 9% dan 15% lebih rendah, protein kasar 16% dan 27% lebih rendah, dan kandungan fenolik 6% dan 19% lebih rendah, masing-masing, dibandingkan dengan iradiasi rendah [ 32 ]. Sebaliknya, suhu rendah menghasilkan 16% asam lemak lebih rendah, 31% kandungan protein kasar lebih tinggi, dan 10% kandungan karbohidrat total lebih rendah dibandingkan dengan suhu tinggi [ 32 , 33 ] (Tabel 2 ). Penambahan nutrisi (terutama 150 dan 500 μmol L −1 nitrat) meningkatkan kualitas biomassa dalam hal protein kasar sebesar 193 dan 228%, asam lemak sebesar 31% dan 35%, dan kandungan fenolik sebesar 51% dan 47%, dan menurunkan kandungan karbohidrat total sebesar 13% dan 15% [ 32 , 33 ] (Tabel 2 ).
Agar rumput laut menjadi sumber protein alternatif yang dapat dipertahankan, kondisi budidaya perlu dioptimalkan untuk memaksimalkan kandungan protein. Panen awal dan penambahan nutrisi akan meningkatkan kemungkinan biomassa dengan kandungan protein tinggi [ 32 , 33 ], tetapi kandungan protein rumput laut umumnya lebih rendah daripada tanaman yang dibudidayakan secara tradisional, seperti kacang kedelai (dengan kandungan protein kasar 35%–40% dw) [ 64 ]. Salah satu cara untuk meningkatkan kandungan protein adalah dengan membudidayakan rumput laut dalam air proses yang kaya nutrisi dari industri makanan [ 3 ]. Dalam percobaan penyaringan, laju pertumbuhan dan kandungan protein kasar dari tiga spesies rumput laut hijau ( U. fenestrata, U. intestinalis , dan Chaetomorpha linum ) dibandingkan setelah 8 hari budidaya dalam dua pengenceran (menyediakan 20 dan 200 μmol L −1 amonium) dari 8 air proses yang berbeda [ 65 ]. Perairan proses berasal dari akuakultur salmon, produksi udang kupas, ikan haring yang diasinkan, dan produk berbasis oat, dan dua kontrol disertakan (air laut dengan konsentrasi nutrisi sekitar dan air laut yang diperkaya dengan NH4Cl ) [ 65 ]. Laju pertumbuhan rumput laut hijau hingga 62%, 63%, dan 18% lebih tinggi (17,3%, 8,2%, dan 9,5% d −1 ), dan kandungan protein kasar hingga 131%, 256%, dan 283% lebih tinggi (23,2%, 21,9%, dan 25,1% dw) di U. fenestrata , U. intestinalis , dan C. linum , masing-masing ketika dibudidayakan di perairan proses produksi pangan, dibandingkan dengan kontrol air laut [ 65 ]. Rata-rata laju pertumbuhan 20% lebih tinggi pada keberadaan 20 μmol L −1 dibandingkan dengan 200 μmol L −1 amonium (8,5% vs. 7,1% d −1 ), yang menunjukkan bahwa konsentrasi amonium yang tinggi dapat menghambat pertumbuhan rumput laut [ 66 ].
Ulva fenestrata selanjutnya diuji sebagai spesies kandidat dalam sistem produksi sirkular di mana nutrisi dalam air proses produksi ikan haring (HPPW) digunakan untuk menghasilkan biomassa kaya protein yang berkelanjutan [ 34 – 36 , 65 ]. Efek dari dua jenis HPPW pada pertumbuhan U. fenestrata dan kandungan protein kasar diuji dalam dua percobaan budidaya tangki [ 34 ]. Air proses tersebut meliputi air garam jenuh dari pematangan fillet ikan haring (SAL) dan air bak dari penyimpanan pra-pemrosesan internal ikan haring utuh dalam 3% NaCl (TUB). HPPW diencerkan hingga mengandung 25 μmol L −1 amonium, dan air laut digunakan sebagai kontrol. Percobaan pertama berlangsung selama 28 hari, dan terdapat hasil biomassa 342% dan 505% lebih tinggi pada perlakuan SAL dan TUB, masing-masing, dibandingkan dengan kontrol, yang dengan jelas menunjukkan bahwa U. fenestrata tumbuh dengan sukses di kedua HPPW. Dalam percobaan kedua yang berlangsung selama 14 hari, hasilnya 69% dan 86% lebih tinggi di HPPW dibandingkan dengan kontrol [ 34 ] (Tabel 2 ). Lebih jauh lagi, kandungan protein kasar meningkat hingga ≈30% dw di U. fenestrata yang diberi perlakuan HPPW (peningkatan 146%–261% dibandingkan dengan kontrol), sementara tidak ada perbedaan signifikan antara HPPW [ 34 ] (Tabel 2 ). Hasil-hasil ini menunjukkan bahwa meskipun U. fenestrata tumbuh dengan baik di kedua HPPW, air TUB menghasilkan biomassa tertinggi. Lebih jauh lagi, kandungan protein kasar di U. fenestrata dapat ditingkatkan hampir ke tingkat kedelai setelah hanya 14 hari pembudidayaan [ 34 ]. [ 34 ] juga mengukur komposisi asam amino (AA) dan kandungan logam berat dari rumput laut dan menemukan bahwa sebagian besar AA hadir setidaknya dua hingga tiga kali lebih tinggi di rumput laut yang diobati dengan HPPW dibandingkan dengan kontrol. Untuk menerima semua AA esensial yang dibutuhkan dari U. fenestrata , seseorang perlu makan sekitar 230 g dw per hari, yang dapat dibandingkan dengan 170 g dw kedelai [ 64 ]. Lebih jauh lagi, kandungan logam berat dalam biomassa berada di bawah konsentrasi maksimum yang diizinkan dalam bahan pangan yang ditetapkan oleh komisi komunitas Eropa [ 67 , 68 ].
Dua penelitian sebelumnya [ 34 , 65 ] dengan jelas menunjukkan bahwa pertumbuhan dan kandungan protein kasar U. fenestrata (dan spesies rumput laut hijau lainnya) dapat ditingkatkan dalam kultur tangki skala kecil. Budidaya berbasis laut, di sisi lain, menawarkan metode praktis dan hemat biaya untuk memproduksi biomassa dalam jumlah besar pada skala komersial yang besar [ 30 ], tetapi pertumbuhan dan kualitas biomassa bergantung pada musim [ 31 ]. Memaksimalkan hasil dengan memanen di akhir musim menghasilkan biomassa dengan kandungan protein kasar yang rendah [ 69 ]. Oleh karena itu, Stedt et al. [ 35 ] menyelidiki apakah budidaya di HPPW dapat digunakan sebagai perawatan pasca panen jangka pendek untuk meningkatkan kandungan protein kasar U. fenestrata yang dipanen dari budidaya berbasis laut pada waktu yang optimal dalam hal hasil, tetapi sub-optimal dalam hal kandungan protein. Individu U. fenestrata yang dikumpulkan dari budidaya berbasis laut pada akhir Mei dan dengan kandungan protein kasar 3,67% ± 0,22% dw (rata-rata ± SEM), dipindahkan ke air proses TUB atau SAL [ 35 ]. Setelah 14 hari, hasil biomassa meningkat sebesar 40,2% dan 30,5% pada rumput laut yang diolah dengan HPPW dibandingkan dengan kontrol (Tabel 2 ). Meskipun kandungan protein kasar tidak mencapai tingkat yang ditemukan pada penelitian sebelumnya [ 34 , 65 ], kandungan protein kasar pada rumput laut yang diolah dengan HPPW meningkat secara signifikan sebesar 320% dan 488% (menjadi 12% dan 17% dw) pada air SAL dan TUB, masing-masing [ 35 ] (Tabel 2 ).
Dalam percobaan lanjutan, Steinhagen et al. [ 36 ] menggunakan U. fenestrata yang dipanen pada kandungan protein puncak alaminya di akhir Februari untuk menguji apakah perlakuan pasca panen dengan HPPW dapat mengoptimalkan hasil dan kandungan protein rumput laut lebih jauh lagi. Ketika biomassa rumput laut dengan kandungan protein kasar 21,83% ± 1,25% dw (rata-rata ± SD) terkena air TUB selama 14 hari, biomassa tumbuh sebesar 22,9 ± 0,3 (rata-rata ± SD). Lebih jauh lagi, kandungan protein kasar meningkat secara signifikan sebesar 72% dibandingkan dengan kandungan protein kasar pada saat panen ke level 37,4% ± 1,8% dw (rata-rata ± SD) [ 36 ] (Tabel 2 ). Studi-studi ini dengan jelas menunjukkan bahwa HPPW dapat digunakan sebagai sumber nutrisi berkelanjutan untuk U. fenestrata dan bahwa kandungan protein kasar dalam rumput laut dapat ditingkatkan ke tingkat kedelai (35%–40% dw) [ 64 ] setelah hanya 14 hari budidaya [ 34 – 36 ]. Ini adalah kandungan protein kasar tertinggi yang dilaporkan untuk biomassa Ulva yang ditanam secara komersial [ 36 ] dan metodologi yang dijelaskan dapat diterapkan oleh petani sebagai pasca-perlakuan yang memberikan nilai tambah pada tanaman rumput laut. Lebih jauh, analisis sensoris biomassa dilakukan di mana panel uji menilai penampilan, bau, rasa, aroma, dan tekstur biomassa [ 36 ]. Rumput laut yang dibudidayakan di HPPW memiliki bau yang lebih kuat dan warna hijau dibandingkan dengan rumput laut kontrol, yang menunjukkan bahwa kandungan protein berkorelasi positif dengan intensitas warna.
3.2.4 Hubungan Antara Kandungan Protein dan Warna
Kuantifikasi kandungan protein dalam jaringan rumput laut biasanya melibatkan metode yang memerlukan prosedur laboratorium dan memakan waktu serta mahal. Bagi petani untuk memperkirakan kandungan protein tanaman, diperlukan metode alternatif yang murah, cepat, dan sebaiknya dapat dilakukan di lapangan. Hubungan antara kandungan nitrogen dan warna U. fenestrata dipelajari dalam rumput laut yang diambil sampelnya dari budidaya berbasis laut [ 70 ]. Rumput laut diambil sampelnya setiap minggu selama 15 minggu dimulai pada awal Maret dan mencakup seluruh musim panen [ 70 ]. Warna ditentukan dengan menganalisis foto rumput laut untuk tiga warna pita merah, hijau, dan coklat (nilai RGB). Kandungan nitrogen berkisar antara 0,54% hingga 5,22% dw selama periode pengambilan sampel. Model regresi menunjukkan bahwa analisis citra warna secara akurat memperkirakan kandungan nitrogen baik untuk jaringan rumput laut segar ( R 2 = 0,944) dan untuk bubuk kering ( R 2 = 0,827) [ 71 ]. Berdasarkan model-model ini, penulis mengembangkan aplikasi berbasis web yang secara otomatis memperkirakan kandungan nitrogen U. fenestrata dari gambar yang diunggah ( https://www.seaweed-nitrogen.com ). Lebih jauh lagi, panduan warna berdasarkan sistem warna Pantone dikembangkan [ 70 ]. Dengan menggunakan aplikasi berbasis web dan panduan warna, petani rumput laut dapat menilai kandungan nitrogen (dan dengan demikian protein kasar) dari tanaman mereka dengan cepat dan efektif tanpa memerlukan analisis kimia yang mahal.
3.3 Budidaya Rumput Laut Swedia di Kondisi Payau
Saccharina latissima dan U. fenestrata keduanya adalah spesies laut penuh yang tidak terdapat di pantai timur Swedia. Namun, Laut Baltik memiliki konsentrasi nutrisi tinggi yang menawarkan banyak peluang untuk budidaya rumput laut. Pendekatan tinjauan sistematis yang digunakan dalam penelitian ini hanya menemukan tiga makalah yang menyelidiki pertumbuhan rumput laut yang berasal dari Laut Baltik [ 71 – 73 ]. Haglund dan Pedersén [ 71 ] menguji teknik budidaya semprot untuk membudidayakan spesies rumput laut Swedia ( Furcellaria lumbricalis, C. crispus, Ahnfeltia plicata, F. vesiculosus dan U. lactuca ) menggunakan air payau (7 PSU) atau air payau dengan penambahan NaCl (15–20 PSU). Tujuannya adalah untuk menyelidiki apakah mungkin untuk memanfaatkan bagian dari pantai timur Swedia untuk membudidayakan rumput laut dari kondisi laut. Fasilitas budidaya semprot didirikan di rumah kaca di lepas pantai timur laut Gotland di pantai timur Swedia. Rumput laut dipelihara pada jaring berlapis, dan air disemprotkan ke lapisan paling atas dan dibiarkan menetes melalui lapisan bawah (laju aliran antara 10 dan 17 L m −2 min −1 ). Rumput laut dibudidayakan antara 2 dan 17 minggu tergantung pada spesiesnya [ 71 ]. Morfologi spesies mempengaruhi kesesuaiannya untuk dibudidayakan pada jaring dalam kultur semprot. Bentuk Baltik dari F. lumbricalis terlalu lunak dan dianggap tidak cocok untuk budidaya semprot, tetapi bentuk laut dari F. lumbricalis , serta C. crispus dan F. vesiculosus , dianggap sebagai spesies yang cocok. Fucus vesiculosus memiliki laju pertumbuhan tertinggi sebesar 0,9% hari −1 setelah 8 minggu budidaya. Ulva lactuca juga memiliki tingkat pertumbuhan yang tinggi (2,5% hari -1 setelah 8 minggu budidaya) tetapi tidak cocok untuk budidaya semprot karena fragmentasi talus setelah peristiwa reproduksi [ 71 ]. Chondrus crispus memiliki tingkat pertumbuhan yang lebih rendah (0,5% hari -1 selama 17 minggu), mungkin karena pemutihan pada suhu tinggi [ 71 ].
Laju pertumbuhan F. vesiculosus yang berasal dari Laut Baltik utara (salinitas alami 5 PSU) diselidiki dalam kultur akuarium dengan air laut buatan pada berbagai tingkat salinitas (5, 10, 20, 35, 45 PSU), karbon organik terlarut (DIC, 1 dan 2 mmol L −1 ), dan nutrisi (0,05 dan 0,2 μmol L −1 amonium, 3 dan 12 μmol L −1 nitrat, dan 0,185 dan 0,75 μmol L −1 fosfat) selama 5 minggu [ 72 ]. Kontrol dibudidayakan di air laut alami dari Laut Baltik. Fucus vesiculosus memiliki laju pertumbuhan relatif tertinggi (2,1%–2,2% hari -1 atau 202% lebih tinggi daripada kontrol) pada DIC tinggi dan konsentrasi nutrisi dalam 10–20 PSU [ 72 ]. Meskipun penelitian ini tidak ditujukan untuk mengoptimalkan akuakultur rumput laut, hasilnya menunjukkan bahwa F. vesiculosus dari Laut Baltik dapat dipelihara dalam budidaya tangki untuk mencapai laju pertumbuhan yang relatif tinggi dalam kondisi payau, dan bahwa itu mungkin merupakan spesies yang menarik untuk pengembangan lebih lanjut budidaya rumput laut di Laut Baltik. Lebih jauh, Steinhagen dan rekan kerja [ 73 ] menyelidiki dampak budidaya jangka panjang (8 minggu) dalam salinitas yang berbeda (berkisar antara 5 hingga 30 PSU) pada laju pertumbuhan dan kandungan protein kasar dari 8 galur Ulva dari berbagai salinitas sumber (7–30 PSU). Sebagian besar galur menunjukkan laju pertumbuhan dan kandungan protein kasar yang lebih tinggi ketika tumbuh pada salinitas rendah, terlepas dari salinitas populasi sumber.
4 Diskusi
Akuakultur rumput laut Swedia yang bertujuan untuk mengoptimalkan hasil dan kualitas biomassa memiliki sejarah yang singkat tetapi telah berkembang pesat selama dekade terakhir. Dua spesies, rumput laut S. latissima dan rumput laut hijau U. fenestrata , telah menerima perhatian paling besar dengan budidaya yang berhasil di kedua sistem budidaya berbasis laut ( S. latissima , U. fenestrata ) dan berbasis darat ( U. fenestrata ). Untuk mencapai industri akuakultur rumput laut yang berkelanjutan dan layak secara ekonomi, integrasi berbagai faktor biologis, lingkungan, dan operasional sangat penting. Pendekatan ini harus mempertimbangkan persyaratan pertumbuhan khusus spesies, variabilitas genetik, dan interaksi dalam lingkungan budidaya. Selain itu, memahami dampak faktor abiotik seperti cahaya, suhu, ketersediaan nutrisi, dan kimia air sangat penting. Mengintegrasikan aspek-aspek ini dengan teknik budidaya dan praktik manajemen yang maju dapat memastikan optimalisasi hasil dan kualitas biomassa sambil menjaga keseimbangan ekologi dan kelayakan ekonomi.
4.1 Budidaya Perairan Saccharina latissima
Mengoptimalkan fase budidaya berbasis darat dan laut penting untuk kelangsungan ekonomi akuakultur S. latissima . Mengurangi waktu dalam fase berbasis darat menggunakan penyemaian langsung dengan pengikat tanpa mengorbankan kualitas sporofit, dan memilih waktu penyebaran dan panen yang optimal, serta lokasi budidaya, berdasarkan variabel lingkungan dapat meningkatkan produktivitas dan profitabilitas. Namun, untuk S. latissima Swedia , penyemaian langsung dengan pengikat tidak berhasil [ 22 ]. Periode pra-budidaya berbasis darat minimal 4 minggu adalah optimal, yang menghasilkan sporofit yang jauh lebih besar dibandingkan dengan periode yang lebih pendek [ 23 ]. Hasil ini menguatkan temuan untuk S. latissima Norwegia dan Denmark [ 74 , 75 ]. Di Norwegia, hasil biomassa terendah untuk sporofit yang disemai dengan pengikat dan langsung dipindahkan ke lokasi budidaya dan tertinggi untuk sporofit yang disemai sebagai spora dan dipindahkan setelah fase penetasan berbasis darat selama 42 hari [ 74 ]. Di Denmark, sporofit yang langsung ditanami dengan binder umumnya berkinerja buruk dibandingkan dengan yang ditanam menggunakan metode tradisional, kecuali di satu lokasi terbuka yang disebarkan pada bulan November, di mana tidak ada perbedaan signifikan antara perlakuan yang diamati [ 75 ]. Waktu penyebaran juga mempengaruhi hasil atau ukuran S. latissima Swedia [ 43 ], Norwegia [ 76 – 78 ], dan Denmark [ 75 ] , dengan penyebaran lebih awal umumnya menghasilkan sporofit yang lebih besar dibandingkan dengan penyebaran selanjutnya. Kualitas biomassa dipengaruhi oleh penyebaran dan waktu panen di beberapa lokasi termasuk Swedia [ 23 ], Norwegia [ 76 – 80 ], dan Denmark [ 75 ], tetapi tidak di Kepulauan Faroe [ 81 ]. Hasil ini mungkin mencerminkan perubahan musiman dalam variabel lingkungan perairan pantai Skandinavia, dibandingkan dengan kondisi Atlantik yang relatif stabil di Kepulauan Faroe [ 81 ].
Selain variabilitas musiman, beberapa studi Skandinavia menunjukkan variasi spasial yang besar dalam kondisi budidaya berbasis laut untuk S. latissima [ 23 , 24 , 75 , 76 , 79 , 80 , 82-84 ]. Secara umum, sporofit tumbuh paling baik pada kedalaman dangkal [ 23, 76, 79, 80, 84], paparan sedang hingga tinggi [24, 75 , 83 ] , suhu rendah ( [ 84 ] , tetapi lihat [ 80 ] ) , salinitas tinggi [ 83 , 84 ], dan tingkat nutrisi tinggi [ 82 , 84 ]. Lebih jauh lagi, tingkat nutrisi yang lebih tinggi di dekat ikan atau akuakultur bivalvia meningkatkan pertumbuhan S. latissima dalam sistem IMTA [ 27 , 76 ]. Selain itu, integrasi budidaya rumput laut dengan budidaya bivalvia memberikan manfaat seperti pengurangan biofouling [ 27 ], yang menunjukkan bahwa kapasitas penyaringan bivalvia secara tidak langsung dapat menguntungkan akuakultur rumput laut dengan mengurangi organisme pengotor. Secara bersamaan, temuan ini menyoroti pentingnya pemilihan lokasi yang cermat dan pertimbangan variabel lingkungan untuk keberhasilan budidaya S. latissima .
4.2 Akuakultur Ulva spp.
Berbeda dengan akuakultur Saccharina latissima , budidaya Ulva spp. kurang mendapat perhatian tetapi masih merupakan spesies penting di sektor akuakultur Eropa [ 85 ]. Hal ini juga tercermin dalam jumlah studi yang diterbitkan untuk budidaya Ulva spp di Eropa Utara. Karakteristik morfologi saja telah terbukti tidak memadai untuk mengidentifikasi spesies dalam genus Ulva secara andal [ 18 ]. Oleh karena itu, nama spesies yang dilaporkan dalam studi sebelumnya yang tidak menggunakan penanda molekuler untuk identifikasi harus ditafsirkan dengan hati-hati. Sejauh pengetahuan kami, optimalisasi fase pra-budidaya berbasis darat, serta budidaya berbasis laut pada long-line, hanya dipelajari di Ulva fenestrata Swedia . Hasil dari tinjauan ini menunjukkan bahwa kepadatan kawanan dan suhu memiliki dampak yang relatif kecil pada pertumbuhan dan kandungan biokimia juvenil U. fenestrata selama fase pra-budidaya berbasis darat, sementara penambahan nutrisi sangat penting untuk perkembangan normal [ 29 ]. Di sisi lain, kepadatan kawanan tinggi pada fase pra-budidaya secara signifikan meningkatkan hasil selama fase budidaya berbasis laut [ 30 ], menekankan pentingnya kepadatan penyemaian awal. Namun, penambahan nutrisi dan suhu memiliki efek minimal pada hasil dewasa dan kandungan biokimia [ 30 ], menunjukkan bahwa fase pra-budidaya terutama menyiapkan panggung untuk pertumbuhan, sementara kondisi lingkungan selama fase berbasis laut memainkan peran penting dalam hasil akhir dan kualitas tanaman. Menariknya, gametofit U. fenestrata rekombinan menunjukkan pertumbuhan dan profil biokimia yang lebih unggul dibandingkan dengan gametofit klonal, menyoroti potensi manfaat penggunaan gametofit rekombinan dalam budidaya berbasis darat. Di sisi lain, gametofit klonal tidak memerlukan prosedur pembuahan untuk perbanyakan dan oleh karena itu mungkin lebih mudah ditangani dari perspektif akuakultur. Adapun S. latissima , waktu panen dalam budidaya U. fenestrata berbasis laut sangat penting untuk mengoptimalkan hasil dan kualitas biomassa, karena ada trade-off dengan hasil yang lebih tinggi diperoleh di akhir musim dan kualitas yang lebih tinggi (protein, asam lemak, dan pigmen) yang diamati pada panen sebelumnya [ 31 ]. Trade-off ini memerlukan perencanaan strategis berdasarkan penggunaan biomassa yang dimaksudkan. Misalnya, panen awal mungkin lebih disukai untuk aplikasi makanan yang membutuhkan kandungan nutrisi tinggi, sementara panen selanjutnya mungkin lebih cocok untuk produksi biomassa massal untuk biomaterial.
Budidaya tangki dalam ruangan menawarkan kontrol yang tepat atas kondisi lingkungan, yang memungkinkan optimalisasi pertumbuhan dan kandungan biokimia. Iradiasi tinggi dan suhu rendah ditemukan optimal untuk pertumbuhan U. fenestrata Swedia , meskipun kondisi ini mengakibatkan kualitas biokimia yang lebih rendah dalam hal asam lemak, protein, dan kandungan fenolik [ 56 ]. Sebaliknya, penambahan nutrisi, khususnya nitrat, secara signifikan meningkatkan kandungan protein, asam lemak, dan fenolik, meskipun dengan mengorbankan kandungan karbohidrat [ 33 , 57 ]. Sesuai dengan hasil ini, Bruhn dan rekan kerja [ 86 ] menemukan korelasi positif antara iradiasi dan produksi biomassa, rasio C:N jaringan dan kandungan monosakarida di U. lactuca Denmark . Hal ini menunjukkan bahwa manipulasi kondisi budidaya yang ditargetkan dapat menghasilkan biomassa yang disesuaikan dengan kebutuhan nutrisi atau industri tertentu.
Potensi penggunaan air proses kaya nutrisi dari industri makanan untuk meningkatkan pertumbuhan dan kandungan protein U. fenestrata telah dieksplorasi dengan hasil yang menjanjikan [ 34-36 , 65 , 69 , 87 ] . Air proses dari produksi ikan haring secara signifikan meningkatkan hasil dan kandungan protein, menjadikan kadar kandungan protein U. fenestrata mendekati kadar kedelai [ 36 ], sekaligus mendorong keberlanjutan dengan mendaur ulang produk samping industri. Lebih jauh lagi, U. lactuca Denmark juga meningkatkan laju pertumbuhan, serta kandungan asam amino dan atau protein ketika ditanam dalam pupuk cair [ 87 ] dan air buangan dari lumpur air yang dicerna [ 69 ]. Pertumbuhan dan peningkatan protein Ulva spp. yang berhasil ketika dibudidayakan dalam air proses menunjukkan metode yang layak untuk mengintegrasikan budidaya rumput laut ke dalam model ekonomi sirkular. Untuk memfasilitasi penerapan praktis dari temuan ini, hubungan antara kandungan protein dan warna dalam U. fenestrata ditetapkan. Kandungan nitrogen, yang merupakan proksi untuk protein, berkorelasi kuat dengan warna rumput laut [ 70 ]. Hal ini menyebabkan pengembangan aplikasi berbasis web dan panduan warna menggunakan sistem Pantone, yang memungkinkan petani memperkirakan kandungan protein dengan cepat dan akurat tanpa analisis laboratorium yang ekstensif. Inovasi ini dapat secara signifikan memperlancar pemantauan dan pengoptimalan tanaman rumput laut di lingkungan komersial.
5 Kesimpulan
Akuakultur rumput laut Swedia telah mengalami kemajuan yang signifikan selama dekade terakhir, dengan upaya penelitian yang terfokus pada Saccharina latissima dan Ulva fenestrata yang meletakkan dasar yang kuat untuk mengoptimalkan hasil dan kualitas biomassa. Tinjauan ini menyoroti bagaimana keberhasilan dalam budidaya rumput laut bergantung pada pengintegrasian biologi khusus spesies dengan wawasan lingkungan, genetik, dan operasional. Untuk S. latissima , penyempurnaan fase berbasis lahan, pemilihan jendela penyebaran dan panen yang optimal, dan pemanfaatan variabilitas spasial telah terbukti penting untuk memaksimalkan hasil dan kualitas produk. Demikian pula, budidaya U. fenestrata telah menunjukkan bahwa kepadatan penyemaian pra-budidaya, waktu panen, dan pengendalian lingkungan—terutama dalam sistem berbasis lahan—merupakan pendorong utama produktivitas dan komposisi biokimia. Strategi inovatif seperti penggunaan gametofit rekombinan, integrasi dengan akuakultur bivalvia, dan penggunaan kembali air proses yang kaya nutrisi menggarisbawahi potensi budidaya rumput laut Swedia untuk berkontribusi pada model keberlanjutan dan ekonomi sirkular. Alat seperti panduan estimasi protein berbasis warna lebih lanjut menjembatani penelitian dan praktik, menawarkan solusi yang dapat diskalakan untuk aplikasi komersial. Ke depannya, pengembangan di masa mendatang harus difokuskan pada perluasan keanekaragaman spesies, peningkatan pemilihan galur melalui alat molekuler, dan peningkatan sistem multi-trofik dan berbasis daratan yang terintegrasi. Karena minat global terhadap rumput laut terus tumbuh, kasus Swedia menawarkan wawasan berharga untuk membudidayakan rumput laut di daerah beriklim sedang dan non-tradisional. Investasi berkelanjutan dalam penelitian, inovasi, dan kolaborasi interdisipliner akan sangat penting untuk sepenuhnya membuka potensi ekologis dan ekonomi akuakultur rumput laut.



Leave a Reply