ABSTRAK
Penemuan kembali struktur yang diketahui merupakan masalah yang sering terjadi dalam penyaringan produk alami bakteri bioaktif (NP). Sistem kultivasi pelat mikrotiter yang sangat paralel (MPCS) dapat meningkatkan peluang untuk menemukan NP baru dengan menguji banyak kondisi kultivasi secara bersamaan. Namun, analisis dan perbandingan mendalam sistem kultivasi untuk penemuan NP belum dilakukan sejauh ini. Kami membandingkan pertumbuhan dan jejak metabolik dari empat spesies bakteri yang berbeda dalam tiga MPCS, labu goyang, dan bioreaktor tangki pengaduk (STR). Sementara sebagian besar sistem kultivasi memberikan pertumbuhan yang baik, kami menemukan perbedaan yang cukup besar dalam pembentukan metabolit sekunder (SM). Ruang SM diperkirakan dengan munculnya fitur massa unik (MF) dalam ekstrak supernatan selama periode kultivasi. Analisis jaringan molekuler diterapkan untuk memvisualisasikan perubahan dari MF yang terdeteksi pada tingkat molekuler. Sistem kultivasi memiliki dampak kecil pada Bacillus amyloliquefaciens yang tumbuh uniseluler . Dampak ini lebih terasa pada bakteri berfilamen yang diuji, yang menghasilkan jejak metabolisme yang beragam. Tumpang tindih maksimal 31% dari MF yang diproduksi menunjukkan kurangnya perbandingan antara sistem kultivasi, yang menghasilkan entri fase pertumbuhan yang berbeda dan pembentukan SM terkait. SM yang terdeteksi dan turunannya menunjukkan modifikasi struktural tergantung pada sistem kultivasi. Perbandingan profil NP Streptomyces griseochromogenes mengungkapkan bahwa MPCS menghasilkan pembentukan SM yang kurang berbeda daripada tabung goyang. Penilaian komprehensif kami adalah yang pertama menunjukkan dampak sistem kultivasi pada jejak metabolisme bakteri, yang mengonfirmasi bahwa MPCS menyediakan platform yang kuat untuk paralelisasi kultivasi bakteri untuk penemuan NP bakteri dan mengakses ruang NP kimia secara lebih luas.
Singkatan
BSF
Labu goyang yang membingungkan
Pusat kebugaran
Glukosa-ragi-malt
HPLC
Kromatografi cair kinerja tinggi
LC-MS/MS
Kromatografi cair-spektrometri massa
maxOTR
Tingkat transfer oksigen maksimum
P/V maks
Daya masukan spesifik volume maksimum
MF
Fitur massal
MPC
Sistem budidaya pelat mikrotiter
Tidak ada
Produk alami
Bahasa Inggris
Labu goyang
STR
Bioreaktor tangki pengaduk
SM
Metabolit sekunder
24 DWP
Plat sumur dalam 24 sumur
96 DWP
Plat sumur dalam 96 sumur
48FP
Plat bunga 48 sumur
1 Pendahuluan
Produk alami bakteri (NP) tetap menjadi sumber molekul bioaktif baru yang berharga (Monciardini et al. 2014 ; Newman dan Cragg 2020 ). Mayoritas NP dikodekan oleh gugus gen biosintetik khusus dan ekspresinya biasanya dibungkam selama kultivasi standar. Di bawah kondisi kultivasi tertentu, aktivasi gugus ini dapat diinduksi. Karena kesulitan yang melekat dalam mengidentifikasi kondisi kultivasi yang sesuai untuk menginduksi produksi NP baru, kampanye penyaringan NP bakteri sering kali menghasilkan penemuan kembali NP yang sebelumnya dikenal (Long et al. 2014 ; Monciardini et al. 2014 ; Seyedsayamdost 2019 ). Akibatnya, metode yang efektif untuk memparalelkan kultivasi diperlukan untuk secara signifikan meningkatkan hasil dalam penemuan NP baru (Bode et al. 2002 ; Nothias et al. 2018 ; Zarins-Tutt et al. 2016 ). Penggunaan sistem kultivasi pelat mikrotiter (MPCS) dapat terbukti menjadi cara yang efektif untuk meningkatkan hasil pengujian berbagai kondisi kultivasi secara bersamaan (Klöckner dan Büchs 2012 ; Lattermann dan Büchs 2015 ).
Budidaya dalam labu kocok (SF) masih mewakili keadaan seni dalam budidaya bakteri (Duetz dan Witholt 2004 ; Katz dan Baltz 2016 ; Zarins-Tutt et al. 2016 ). Dalam budidaya SF, laju transfer oksigen maksimum (maxOTR) dan daya masukan spesifik volume maksimum (maxP/V) mencapai hingga 35 mM/jam dan 200 W/m 3 , masing-masing (Tabel 1 ). Peningkatan lebih lanjut dalam maxOTR dan maxP/V dicapai dengan penggunaan labu kocok bersekat (BSF) (Büchs 2001 ; Li et al. 2013 ; Running dan Bansal 2016 ). Seiring berjalannya waktu, sejumlah bentuk MPCS yang berbeda telah dikembangkan dan diperkenalkan (Long et al. 2014 ). Salah satu varian MPCS adalah pelat sumur dalam (DWP) 24 dan 96 yang tidak termonitor yang dikombinasikan dengan sistem Duetz (Duetz et al. 2000 ; Duetz 2007 ; Duetz dan Witholt 2004 ). Budidaya dalam DWP menghasilkan maxOTR dan maxP/V sebesar 38 mM/h dan 1000 W/m 3 untuk 96 DWP dan 110 mM/h dan 100 W/m 3 untuk 24 DWP (Duetz dan Witholt 2004 ; Running dan Bansal 2016 ; Zhang et al. 2008 ). MPCS lain adalah pelat bunga (FP) 48-sumur yang dipantau dengan sistem BioLector, yang memungkinkan pemantauan lebih lanjut informasi bioproses, termasuk pH dan oksigen terlarut (DO) melalui optode noninvasif dan pembentukan biomassa bersama dengan fluoresensi oleh cahaya hamburan balik (Funke et al. 2009 ; Hemmerich et al. 2014 ; Peter Rohe et al. 2012 ). Pelat mikrotiter polistirena berisi 48 sumur dalam berbentuk bunga yang memungkinkan kultivasi paralel dengan maxOTR hingga 110 mM/jam (Funke et al. 2009 ). MaxP/V dari MPCS yang dipantau belum ditentukan tetapi mungkin berkisar antara 100 dan 1100 W/m 3 . Oleh karena itu, semua sistem kultivasi dapat memastikan pertumbuhan minimal dan konsumsi substrat mikroorganisme sebagai prasyarat untuk penemuan NP baru (Minas et al. 2000 ; Sohoni et al. 2012 ; Wang et al. 2017 ; Zacchetti et al. 2018 ). Sejumlah penelitian di bidang penemuan NP telah digunakan dengan MPCS yang tidak terpantau (Adnani et al. 2015 ; Duetz et al. 2000 ; Híreš et al. 2018 ; Lindig et al. 2023 ; Minas et al. 2000 ; Siebenberg et al. 2010 ; Sohoni et al. 2012 ) dan yang terpantau (Huber et al. 2010 ; Kensy et al. 2009b ; Koepff dkk. 2017 ; Kuhl dkk. 2021 ; Motta Dos Santos dkk. 2016 ; Unthan dkk. 2015 ; Wewetzer dkk. 2015 ).
| Sistem budidaya | Bahan | Pola aliran | Volume kerja (mL) | maxOTR (mM/jam) | P/V maks (W/ m3 ) | Referensi |
|---|---|---|---|---|---|---|
| STR | Baja, kaca atau plastik | didefinisikan | > 8 | 377 | tahun 1100 | (Jossen dkk. ( 2017 ); Li dkk. ( 2013 ); Moo-Young dan Butler ( 2011 )) |
| Bahasa Inggris | Kaca atau plastik | didefinisikan | > 5 | 35 | 200 | (Büchs ( 2001 ); Li et al. ( 2013 ); Running dan Bansal ( 2016 )) |
| BSF | Kaca atau plastik | kacau | > 5 | 100 | 260 | (Büchs ( 2001 ); Li et al. ( 2013 ); Running dan Bansal ( 2016 )) |
| 48FP | Polistirena | kacau | 0,8–1,9 | 110 | — | (Funke dan kawan-kawan ( 2009 )) |
| 24 DWP | Polipropilena | didefinisikan | 0,5–2,5 | 110 | 100 | (Duetz dan Witholt ( 2004 ); Running dan Bansal ( 2016 ); Zhang et al. ( 2008 )) |
| 96 DWP | Polipropilena | didefinisikan | 0,5–1 | 38 | 1000 | (Duetz dan Witholt ( 2004 ); Running dan Bansal ( 2016 ); Zhang et al. ( 2008 )) |
Dalam kultivasi cair, sebagian besar bakteri, seperti Bacillales dan Myxobacteria , tumbuh tersebar dalam agregat uniseluler atau multiseluler sederhana (Dusenbery 1998 ; Kumar et al. 2017 ; Sevugapperumal et al. 2021 ; Young 2007 ). Actinobacteria yang tumbuh berfilamen menunjukkan pertumbuhan dan morfologi yang lebih kompleks (Böl et al. 2021 ) dan dapat membentuk hifa multinukleat. Selama kultivasi terendam, hifa ini dapat membentuk pelet, yang mencapai diameter beberapa milimeter. Morfologi bakteri ditemukan memiliki pengaruh yang mendalam pada pembentukan NP (Minas et al. 2000 ; Sohoni et al. 2012 ; Wang et al. 2017 ; Zacchetti et al. 2018 ). Hanya sedikit penelitian yang mendeskripsikan dan membandingkan morfologi, pertumbuhan dan pembentukan NP tergantung pada sistem kultivasi (Minas et al. 2000 ; Siebenberg et al. 2010 ; Sohoni et al. 2012 ; Wewetzer et al. 2015 ). Untuk mencapai pertumbuhan dan pembentukan SM yang sebanding dalam MPCS dan SF, waktu kultivasi diperpanjang (Minas et al. 2000 ), komposisi medium dan maxOTR disesuaikan (Wewetzer et al. 2015 ) atau aditif diperkenalkan, termasuk manik-manik kaca, 3-(N-morpholino)propanesulfonic acid-buffer (Sohoni et al. 2012 ) atau partikel etilen oksida dan propilena oksida yang tersiloksilasi (Siebenberg et al. 2010 ). Lebih jauh lagi, beberapa studi telah menilai skalabilitas dari MPCS ke bioreaktor tangki pengaduk (STR) untuk menetapkan kursus fermentasi yang sebanding, pertumbuhan (Funke et al. 2010 ; Hemmerich et al. 2014 ; Kensy et al. 2009a ; Koepff et al. 2017 ; Minas et al. 2000 ; Sohoni et al. 2012 ; Unthan et al. 2015 ; Wewetzer et al. 2015 ), morfologi (Koepff et al. 2017 ; Sohoni et al. 2012 ), ekspresi protein (Funke et al. 2010 ; Hemmerich et al. 2014 ; Kensy et al. 2009a ; Koepff et al. 2017 ), produksi metabolit primer, seperti asetat dan etanol, (Wewetzer et al. 2015 ) dan beberapa SM terpilih, termasuk actinorhodin dan undecylprodigiosin (Unthan et al. 2015 ). Meskipun demikian, masih belum jelas apakah seluruh ruang SM bakteri dan perubahannya juga bergantung pada sistem kultivasi yang berbeda.
Studi ini adalah yang pertama untuk menilai potensi fitur massa yang terbentuk secara unik (MFs) sebagai proksi untuk ruang SM Bacillus amyloliquefaciens , Corallococcus coralloides , Streptomyces griseochromogenes dan Streptomyces cowlya selama kultivasi di SF, MPCS yang tidak dipantau dan dipantau. Selain itu, analisis deret waktu dari MF yang diproduksi dalam sistem kultivasi digunakan untuk mengevaluasi pengaruh sistem kultivasi pada profil produksi SM dari waktu ke waktu. Ruang SM selanjutnya didekomposisi oleh analisis jaringan molekuler untuk mengikuti produksi SM yang diidentifikasi dan turunan kimianya dalam sistem kultivasi yang digunakan. Kultivasi dalam MPCS, khususnya dalam 48 FP, menghasilkan kinerja terbaik dalam hal pertumbuhan dan total produksi MFs. Akhirnya, S. griseochromogenes dikulturkan dalam STR bench-top untuk menilai skalabilitas profil SM bakteri yang diperoleh dalam MPCS. Temuan kami menunjukkan bahwa strain bakteri yang berbeda menunjukkan sensitivitas yang berbeda-beda terhadap sistem kultivasi yang berbeda, dengan implikasi untuk skalabilitas ke STR. Studi ini memberikan kontribusi berharga pada bidang pembudidayaan paralel dalam penyaringan NP bakteri, menyediakan wawasan baru untuk pemilihan sistem pembudidayaan untuk kampanye penyaringan di masa mendatang.
2 Bahan dan Metode
2.1 Reagen
Bahan kimia yang dibutuhkan untuk persiapan media kultur bersumber dari Carl Roth GmbH + Co KG (Karlsruhe, Jerman). Lebih lanjut, Tabel S1 menyediakan daftar lengkap semua bahan kimia lainnya dan pemasoknya masing-masing.
2.2 Strain dan Komposisi Media
Bakteri B. amyloliquefaciens DSM 7, C. coralloides DSM 2259, S. griseochromogenes DSM 40499, dan S. Cattleya DSM 46488 berasal dari Koleksi Mikroorganisme dan Kultur Sel Jerman (DSMZ, Braunschweig, Jerman). Pemilihan strain bakteri didasarkan pada penelitian sebelumnya, pentingnya sebagai penghasil SM, dan kompleksitas dalam morfologi pertumbuhan (Schwarz et al. 2021 ). Media pertumbuhan yang digunakan adalah media Glukosa-ragi-malt (GYM), yang terdiri dari 4 g/L glukosa, 4 g/L ekstrak ragi, 10 g/L ekstrak malt, dan disesuaikan dengan pH 7,2. Kriokultur yang digunakan dalam penelitian ini berisi kaldu bakteri yang dicampur dengan 10% (v/v) gliserol, disimpan pada suhu −20°C (Kapoore et al. 2019 ).
2.3 Pra-Kultur Bakteri
Kultur inokulum dari keempat bakteri disiapkan menggunakan 1 mL kriokultur dan 19 mL medium GYM dalam 100 mL BSF. Kultur diinkubasi pada pengocok orbital pada kecepatan 200 rpm (diameter 50 mm) dan suhu 30°C selama 24 jam. Semua kultur utama dalam SF, BSF, dan MPCS dari masing-masing bakteri diinokulasi dari satu pra-kultur. Kultur tambahan S. griseochromogenes dalam STR diinokulasi dari satu pra-kultur yang terpisah.
2.4 Budidaya di SF dan BSF
Untuk budidaya SF dan BSF, disiapkan botol 250 mL berisi 2,5 mL inokulum dan 22,5 mL medium GYM segar. Botol-botol ini dibiakkan pada pengocok orbital selama 5 hari pada kecepatan 200 rpm (diameter 50 mm) dan suhu 30°C. Setiap bakteri dibiakkan dalam tiga SF dan tiga BSF. Sebanyak 1 mL sampel diambil dari setiap botol sekali sehari dan disimpan pada suhu -20°C. Selain itu, gambar mikroskopis diambil dari SF pada akhir budidaya menggunakan Axio Lab A1 (Zeiss, Oberkochen, Jerman).
2.5 Budidaya di MPCS
Untuk kultivasi dalam 48 FP, setiap sumur pelat berisi 0,1 mL inokulum dan 0,9 mL medium GYM segar. 48 FP disegel dengan lapisan penyegel non-woven yang dapat menyerap gas dan dikultur dalam BioLector (Beckman Coulter, Aachen, Jerman) selama 5 hari pada 1200 rpm dan 30°C. 48 FP yang dipilih dalam penelitian ini tidak berisi sensor optik untuk deteksi tambahan pH atau DO selama kultivasi. Untuk MPCS yang tidak dipantau, semua sumur dari 24 DWP sistem Duetz (Adolf Kühner, Basel, Swiss) berisi 0,1 mL inokulum dan 0,9 mL medium GYM segar. Sumur dari 96 DWP berisi 0,05 mL inokulum dan 0,45 mL medium GYM segar. MPCS yang tidak termonitor ditutup dengan pelat penutup permeabel yang terdiri dari tutup baja tahan karat, filter serat mikro, filter politetrafluoroetilena, dan lapisan silikon. Kedua pelat dikulturkan pada pengocok orbital selama 5 hari pada 250 rpm (diameter 50 mm) dan 30°C. Untuk setiap bakteri, pelat terpisah digunakan. Secara total, tiga kali lipat sampel 1 mL diambil sekali sehari dan disimpan pada suhu -20°C. Untuk itu, tiga sumur per hari untuk 48 FP dan 24 DWP dipanen seluruhnya. Untuk 96 DWP, dua sumur digabungkan untuk memperoleh 1 mL kultur dan tiga sumur yang dikumpulkan dipanen seluruhnya.
2.6 Budidaya di STR
S. griseochromogenes juga dikulturkan di DASbox STR (Eppendorf, Hamburg, Jerman) dengan 20 mL inokulum dan 180 mL medium GYM segar. Aerasi diatur dengan udara hingga 0,125 vvm dan kecepatan pengaduk dijaga konstan pada 1000 rpm. pH tidak dikontrol selama proses kultivasi. Secara total, 1 mL sampel diambil sekali sehari.
2.7 Persiapan Sampel
Untuk analisis, sampel dari SF, BSF, MPCS, dan STR dicairkan pada suhu kamar. Semua sampel disuspensikan kembali dan dipindahkan seluruhnya ke dalam tabung mikrosentrifus yang telah dikeringkan dan diberi pemberat. Sel dikumpulkan dengan sentrifus selama 20 menit pada 3795 ×g dan 4°C dalam sentrifus SorvallTM Rc 5B Plus (Thermo Fisher, Waltham, MA, AS). Supernatan disaring dengan filter poliamida 0,45 μm (Macherey-Nagel, Düren, Jerman) ke dalam botol kaca dan diencerkan 1:10 dengan air murni.
2.8 Penentuan Pertumbuhan
Konsentrasi biomassa dan glukosa diukur untuk setiap sampel. Konsentrasi biomassa ditentukan dengan mengeringkan semua tabung sampel dengan pelet sel pada suhu 80°C hingga mencapai berat konstan. Semua tabung kemudian didinginkan hingga suhu ruangan dan ditimbang pada timbangan presisi untuk mendapatkan berat kering sel dari 1 mL sampel. Konsentrasi glukosa dari semua sampel diukur menggunakan kromatografi cair kinerja tinggi (HPLC) dengan detektor indeks bias (Agilent 1200 Series/1260 Infinity, Agilent Technologies, Santa Clara, AS), seperti yang dijelaskan sebelumnya dalam Steinmann et al. 2022. Konsentrasi ditentukan dari kurva kalibrasi eksternal standar yang berkisar dari 0 hingga 10 g/L glukosa.
2.9 Pengukuran dan Analisis Data LC-MS/MS
Pengukuran kromatografi cair-spektrometri massa (LC-MS/MS) dilakukan menggunakan ultra-HPLC (1290 Infinity II, Agilent, Santa Clara, CA, AS) yang digabungkan dengan spektrometri massa waktu terbang kuadrupol ionisasi elektrospray (Compact, Bruker, Billerica, MA, AS) dengan pengaturan yang dijelaskan sebelumnya (Lindig et al. 2023 ). Analisis data LC-MS/MS dilakukan menggunakan Analisis Data 4.4 (Bruker, Billerica, MA, AS) dan MZmine 2.35 (Pluskal et al. 2010 ). Langkah-langkah terperinci, pengaturan, dan penyaringan MF diterapkan seperti yang dijelaskan sebelumnya (Lindig et al. 2023 ). Hanya MF yang ada di ketiga sampel yang diambil dari sistem kultivasi yang dipertimbangkan lebih lanjut. MF dari pra-kultur dan kontrol medium dikecualikan dari semua massa yang terdeteksi dalam daftar fitur. MF yang terdeteksi diberi anotasi menggunakan standar kimia atau pencocokan pustaka dengan pustaka spektral daring GNPS (Wang et al. 2016 ) atau perangkat lunak SIRIUS 5.62 (Dührkop et al. 2019 ), sebagaimana telah dijelaskan sebelumnya (Lindig et al. 2023 ). Contoh anotasi ditunjukkan pada Gambar S1 , S2 .
Untuk menilai profil produksi SM menggunakan deret waktu, kami melakukan analisis klaster hierarkis dalam perangkat lunak SPSS (IBM, Ehningen, Jerman). Untuk pengelompokan hierarkis, metode ward digunakan dengan interval yang diukur dengan jarak Euclidean kuadrat dan standarisasi −1 hingga 1 menurut variabel. Jaringan molekuler dihasilkan menggunakan mode default alur kerja GNPS daring (Wang et al. 2016 ), seperti yang dijelaskan sebelumnya (Lindig et al. 2023 ). Hasil analisis jaringan molekuler divisualisasikan menggunakan Cytoscape versi 3.6.1 (Shannon et al. 2003 ). Kelimpahan tertinggi yang diamati dari setiap node dalam sistem kultivasi dan pelabelan ion dalam jaringan molekuler dilakukan seperti yang dijelaskan sebelumnya (Lindig et al. 2023 ). Selain itu, ukuran diagram lingkaran yang dihasilkan menunjukkan kelimpahan tertinggi yang diamati secara keseluruhan dari setiap node. Profil produksi yang diselidiki melalui deret waktu ditampilkan dalam bentuk di sekitar diagram lingkaran. ChemDraw 20 (PerkinElmer, Waltham, MA, AS) digunakan untuk menghasilkan struktur kimia.
3 Hasil
3.1 Karakterisasi Pertumbuhan dalam Sistem Budidaya
Pertumbuhan keempat bakteri, B. amyloliquefaciens, C. coralloides, S. griseochromogenes dan S. Cattleya , dikarakterisasi selama periode kultivasi 5 hari. Semua bakteri dikultur dalam medium GYM pada suhu 30°C. Biomassa dan konsentrasi glukosa diukur dalam rangkap tiga setiap hari menggunakan analisis berat kering sel dan pengukuran HPLC. Gambar 1 menampilkan pembentukan biomassa, konsumsi glukosa, dan parameter proses yang spesifik untuk setiap sistem kultivasi. Seperti yang diharapkan, kami mengamati korelasi terbalik yang kuat antara konsumsi glukosa dan pembentukan biomassa untuk semua sistem kultivasi dan bakteri yang diuji. Namun, lamanya kultivasi hingga memasuki fase pertumbuhan stasioner, biomassa yang terbentuk, dan glukosa residual berbeda secara signifikan di antara sistem kultivasi yang diuji. Sistem kultivasi yang berbeda memiliki dampak sedang pada lamanya fase pertumbuhan, pembentukan biomassa, dan konsumsi glukosa untuk B. amyloliquefaciens (Gambar 1 ). Sebagian besar glukosa dikonsumsi dalam 24 jam di SF, BSF dan 48 FP, dalam 2 hari di 24 DWP dan dalam 3 hari di 96 DWP. Konsentrasi biomassa yang sebanding diperoleh dalam sistem kultivasi, dengan biomassa terendah 2 g/L tercatat di 96 DWP dan tertinggi 3,9 g/L teramati di 48 FP. Saat membudidayakan C. coralloides , fase stasioner dicapai setelah 1 hari ketika glukosa dikonsumsi sepenuhnya di SF dan 96 DWP. Konsumsi glukosa dan pembentukan biomassa lebih lambat di 24 DWP dan BFS, di mana fase stasioner dicapai pada hari kedua atau ketiga, berturut-turut. Perbedaan pertumbuhan yang nyata dapat diamati di 48 FP, di mana pada akhir kultivasi konsentrasi glukosa residual 1 g/L tertinggal. Hal ini mungkin disebabkan oleh peningkatan tekanan hidromekanik yang disebabkan oleh sekat terpadu dalam 48 FP, yang telah terbukti berdampak negatif pada pertumbuhan bakteri selama proses kultivasi (Funke et al. 2009 ; Khamduang et al. 2009 ; Toma et al. 1991 ). Pembentukan biomassa bervariasi dari minimum 2,5 g/L dalam 96 DWP hingga maksimum 4,9 g/L dalam BFS setelah 5 hari kultivasi. Pertumbuhan yang tersebar diamati dalam sistem kultivasi yang berbeda di semua kultur B. amyloliquefaciens dan C. coralloides.Sistem kultivasi memiliki dampak yang jelas pada pertumbuhan dan konsumsi glukosa dari bakteri yang tumbuh berfilamen. Secara khusus, masuknya ke fase stasioner berbeda dalam waktu dan jumlah biomassa yang terbentuk di semua sistem kultivasi. Faktanya, kultivasi dalam 96 DWP tidak mencapai fase stasioner, sebagaimana dibuktikan oleh peningkatan yang stabil dalam pembentukan biomassa dan penurunan yang stabil dalam glukosa residual selama periode kultivasi 5 hari dari semua bakteri yang tumbuh berfilamen yang diuji. Ini mungkin disebabkan oleh ketersediaan oksigen yang terbatas dikombinasikan dengan peningkatan masukan daya dalam 96 DWP (Tabel 1 ). Ini dapat membatasi pertumbuhan dan penyerapan substrat sel, terutama selama kultivasi Streptomyces berfilamen , yang telah dijelaskan menunjukkan sensitivitas terhadap variasi dalam pencampuran dan aerasi (Minas et al. 2000 ; Sohoni et al. 2012 ). Mengenai sistem kultivasi lainnya, glukosa dalam kultivasi S. griseochromogenes dikonsumsi setelah 3 hari di SF dan setelah 2 hari di BSF, 24 DWP, dan 48 FP. Konsentrasi biomassa tertinggi sebesar 7,9 g/L teramati di BFS dan terendah sebesar 3,5 g/L di 96 DWP. Untuk S. Cattleya , glukosa dikonsumsi sepenuhnya dalam waktu 1 hari di 48 FP, 2 hari di 24 DWP, 3 hari di BSF, dan dalam waktu 4 hari di SF. Di akhir semua kultivasi, konsentrasi biomassa berkisar antara 3,5 g/L di 96 DWP dan 9,3 g/L di 48 FP. Selain itu, kedua bakteri Streptomyces menunjukkan pembentukan pelet yang banyak selama kultivasi di SF dan 96 DWP, dengan peningkatan pertumbuhan pada dinding pembuluh (data tidak ditampilkan). Hasil kami menunjukkan bahwa perilaku pertumbuhan bakteri yang diuji tidak hanya dipengaruhi oleh kapasitas transfer oksigen dari berbagai sistem budidaya, seperti yang ditunjukkan oleh OTR teoritis yang berbeda dari sistem budidaya (Gambar 1 ). Tegangan geser, bahan yang digunakan, dan faktor minor lain yang diteliti menghasilkan karakteristik pertumbuhan yang berbeda dalam sistem budidaya.

3.2 Pengaruh Sistem Budidaya terhadap Metabolisme Sekunder
Sebagai hasil dari karakteristik pertumbuhan yang berbeda dalam sistem kultivasi, kami mempelajari dampaknya pada metabolom sekunder. Kami menentukan jejak metabolik bakteri dalam sistem kultivasi yang berbeda dalam alur kerja metabolomik yang tidak ditargetkan dengan menentukan semua MF dalam sampel supernatan rangkap tiga yang diperoleh pada akhir kultivasi (Gambar 2 ) dan selama periode kultivasi (Gambar 3 , S3 – S6 ). Hanya MF yang hadir dengan kelimpahan lebih dari 1000 dalam semua rangkap tiga dan tidak terdeteksi dalam kontrol medium dan pra-kultur yang dipertimbangkan lebih lanjut.
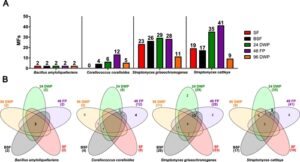
Untuk menyelidiki lebih lanjut dampak sistem kultivasi pada kemunculan SM yang bergantung pada waktu selama seluruh periode kultivasi, kami memantau kemunculan MF setiap hari dan mengelompokkan profil intensitasnya dari waktu ke waktu menggunakan analisis pengelompokan hierarkis. Secara keseluruhan, tiga profil produksi produksi awal , produksi & degradasi , dan produksi akhir diklasifikasikan dalam studi ini, dengan contoh yang diberikan untuk setiap bakteri pada Gambar S3 : Profil produksi awal menggambarkan MF yang dibentuk oleh bakteri setelah satu atau dua hari pertumbuhan dalam sistem kultivasi. Intensitasnya mencapai maksimum dan tetap konstan hingga akhir kultivasi. Profil produksi produksi & degradasi diklasifikasikan saat MF muncul dan menghilang selama kultivasi. MF yang diproduksi setelah 3 atau 4 hari kultivasi dan terus meningkat jumlahnya hingga akhir kultivasi, dikategorikan sebagai profil produksi akhir . Untuk mendapatkan pemahaman yang lebih mendalam tentang hubungan antara MF dan struktur kimianya, anotasi dilakukan dengan membandingkan waktu retensi dan spektrum fragmentasi dengan standar kimia, memanfaatkan pustaka spektral daring GNPS, atau menggunakan alat fragmentasi in-silico SIRIUS. Daftar lengkap semua MF yang terdeteksi beserta anotasinya disediakan pada Tabel S2 .
Analisis pengelompokan yang dilakukan menghasilkan dendrogram dengan dua simpul utama (Gambar 3 ). Simpul pertama berisi dua sub-cabang dengan MF dianalisis untuk profil produksi & degradasinya . Simpul kedua terbagi menjadi dua cabang, satu berisi MF yang diklasifikasikan sebagai profil produksi akhir dan yang lainnya diklasifikasikan sebagai profil produksi awal . Profil produksi awal MF dikelompokkan menjadi dua cabang tambahan. Berdasarkan pengelompokan profil, kami menganalisis perbedaan dalam kemunculan SM dari waktu ke waktu dalam sistem kultivasi yang berbeda (Gambar 3 , S3 – S6 ). Selama kultivasi B. amyloliquefaciens , MF 2.31_256.1241 diamati sebagai profil produksi awal dalam 96 DWP dan tampaknya diproduksi dan terdegradasi dari waktu ke waktu dalam sistem kultivasi lainnya. Ketika membudidayakan C. coralloides dalam sistem kultivasi, perbedaan dalam profil produksi antara sistem kultivasi diamati. Misalnya, pentadecanoylglycine menunjukkan profil produksi produksi & degradasi dalam 24 DWP. Dalam 48 FP, profil produksi produksi awal diamati, yang menunjukkan bahwa tidak ada degradasi pentadecanoylglycine yang terjadi pada 48 FP. Profil produksi akhir diselidiki selama kultivasi di BSF, di mana diasumsikan bahwa periode kultivasi yang diperpanjang mungkin diperlukan untuk mendeteksi degradasi pentadecanoylglycine. Secara umum, 48 FP dan BSF menunjukkan perbedaan dalam permulaan produksi SM yang terdeteksi di C. coralloides . Hal yang sama dapat diamati selama kultivasi bakteri Streptomyces . Secara keseluruhan, bahan kimia desferioksamin menunjukkan perbedaan dalam permulaan produksi, seperti yang dicontohkan untuk desferioksamin E dengan produksi akhir di SF dan produksi awal di sistem kultivasi lainnya. Molekul leupeptin menunjukkan tidak adanya degradasi, seperti yang diamati untuk leupeptin dengan profil produksi produksi awal atau akhir di 96 DWP dan produksi & degradasidalam sistem kultivasi lainnya. Hasil analisis klaster menunjukkan bahwa sistem kultivasi yang diuji memberikan pengaruh yang nyata pada fase pertumbuhan bakteri dan produksi SM yang terkait. Sistem kultivasi yang menunjukkan pertumbuhan yang buruk tampaknya memperpanjang fase pertumbuhan awal, sehingga mengurangi kemungkinan produksi SM di hadapan stresor, karena sebagian besar SM bakteri diproduksi dengan dimulainya fase stasioner (Seyedsayamdost 2019 ). Sebagai kesimpulan, sistem kultivasi yang berbeda jelas memengaruhi waktu produksi dan kemunculan SM dalam jejak metabolik keempat bakteri.
3.3 Hubungan Struktural dan Penjelasan SM yang Terdeteksi
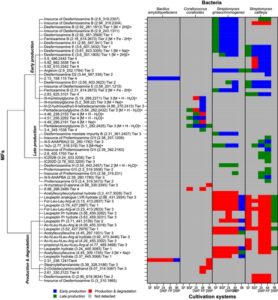
Untuk memperoleh wawasan lebih jauh mengenai modifikasi struktural SM tergantung pada sistem kultivasi, kami melakukan analisis jaringan molekuler. Hal ini memungkinkan visualisasi hubungan struktural antara MF dalam sistem kultivasi yang berbeda (Gambar 4 , S7 – S9 ). Analisis jaringan menghasilkan simpul tunggal dan berkelompok, tergantung pada pola fragmentasi yang dihasilkan dari pengukuran LC-MS/MS.
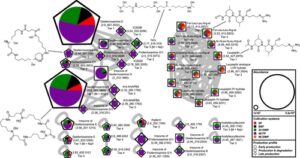
Berikutnya, kami menganalisis modifikasi struktural SM dan turunan terkaitnya. Selama pembudidayaan C. coralloides , perbedaan dalam panjang rantai dan substitusi asam amino diamati pada N -asil-asam amino yang terbentuk (Gambar S10 ). Misalnya, stearoylethanolamide memiliki gugus propil tambahan, sementara N -myristoylglycine kehilangan gugus metil dibandingkan dengan pentadecanoylglycine. 2-(octadecaylamino) etanol mencakup bagian etanol dan N -myristoyl- D -alanine sebuah alanine, bukan glisin dalam pentadecanoylglycine. Selain itu, 2-(octadecaylamino)ethanol kehilangan satu oksigen tambahan dibandingkan dengan stearoylethanolamide. Bakteri Streptomyces menghasilkan beberapa turunan leupeptin dalam penelitian ini (Gambar S11 ). Perbedaan utama dalam modifikasi struktural bahan kimia leupeptin diamati sebagai substitusi asam amino dan residu N-terminal. Misalnya, analog leupeptin LVR mengandung valyl sebagai ganti leucyl, acetylleucylleucyllysinal sebagai lisin sebagai ganti arginin dan leupeptin Pr sebagai residu N -propionyl sebagai ganti N- asetil dibandingkan dengan leupeptin. Selain bahan kimia leupeptin, berbagai turunan desferioksamin diproduksi oleh bakteri Streptomyces (Tabel 2 ). Modifikasi struktural desferioksamin meliputi siklisasi dan perbedaan panjang rantai. Misalnya, desferioksamin E dan desferioksamin Et1, yang memiliki struktur eter tambahan, mewakili bentuk siklik desferioksamin G. Desferioksamin A1 kehilangan satu gugus metil, desferioksamin H tidak memiliki satu struktur kadaverin dan IC202B kehilangan gugus keton dibandingkan dengan desferioksamin B. Analisis pada tingkat molekuler dapat menunjukkan bahwa produksi SM spesifik dan turunannya memerlukan kondisi kultivasi spesifik, yang mencakup kombinasi stresor tertentu yang berasal dari sistem kultivasi dan keseimbangan stresor dan dukungan pertumbuhan yang optimal yang disediakan oleh sistem kultivasi. Keseimbangan optimal tampaknya berbeda tergantung pada kompleksitas morfologi bakteri. Studi ini menunjukkan bahwa sistem kultivasi yang berbeda memengaruhi produksi profil SM yang berbeda dan pembentukan turunan terkait SM.
| Nama b | Massa netral [g/mol] | Rumus penjumlahan | adukan | Tingkat | Struktur | Saring a | Bahasa Inggris | BSF | 24 DWP | 48FP |
|---|---|---|---|---|---|---|---|---|---|---|
| Dari Et1 | 602.7 | C26H46N6O10 | [M + H] + | 2 |  |
SC, SG | √ | √ | √ | √ |
| Des E | 600.7 | C27H48N6O9 | [M + H] +, [M + Na] +, [M + 2H] 2+ | 1 |  |
SC, SG | √ | √ | √ | √ |
| Dari D2 | 586.7 | C26H46N6O9 | [M + H] + | 2 |  |
Bahasa Inggris | √ | |||
| Des G | 618.7 | C27H50N6O10 | [M + H] + | 2 |  |
Bahasa Inggris | √ | √ | √ | |
| Des B | 560.7 | C25H48N6O8 | [M + H] +, [M + 2H] 2 +, [M+ Fe – 2H] + | 1 |  |
SG | √ | √ | √ | √ |
| Dari A1 | 546.7 | C24H46N6O8 | [M + H] + | 3 |  |
SG | √ | √ | √ | √ |
| IC202B | 532.6 | C23H44N6O8 | [M + H] + | 3 |  |
Bahasa Inggris | √ | √ | ||
| Profesional G1t | 518.6 | C23H46N6O7 | [M + H] + | 2 |  |
Bahasa Inggris | √ | |||
| IC202D | 501.6 | C23H43N5O7 | [M + H] + | 3 |  |
Bahasa Inggris | √ | |||
| 1k2v | 495.6 | C21H45N5O8 | [M + H] + | 3 |  |
Bahasa Inggris | √ | √ | √ | |
| Des H | 460.5 | C20H36N4O8 | [M + H – H 2 O] + | 2 |  |
SG | √ | √ | √ | |
| Pengotor des mesylate B | 360.5 | C16H32N4O5 | [M + H] + | 3 |  |
SG | √ | √ | √ | √ |
| N -5-AHAPBA | 259.3 | C11H21N3O4 | [M + H] + | 3 |  |
Bahasa Inggris | √ | √ |
SG = Streptomyces griseochromogenes, SC = Streptomyces cowleya. b Des = Desferioksamin, Pro = Proferioksamin, N-5-AHAPBA = N'-[5-[asetil(hidroksi)amino]pentil]butandiamida.
3.4 Perbandingan Sistem Budidaya dengan STR
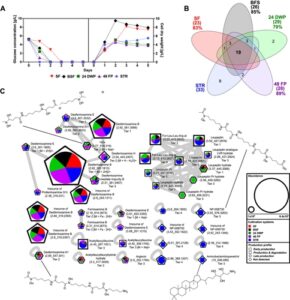
Untuk menentukan tingkat kesamaan ruang SM antara MPCS dan STR, kami membudidayakan S. griseochromogenes dalam STR bench-top selama periode 5 hari. Pembentukan biomassa, konsumsi glukosa dan jejak metabolik diukur setiap hari dan dibandingkan dengan sistem kultivasi lainnya. Sebagai salah satu spesies penghasil NP yang paling penting, S. griseochromogenes dipilih karena kompleksitas morfologi pertumbuhannya dan responsnya yang jelas dalam pertumbuhan dan produksi SM terhadap sistem kultivasi dalam penelitian ini. Data dari 96 DWP dikeluarkan dari perbandingan, karena S. griseochromogenes menunjukkan pertumbuhan dan produksi SM yang buruk dalam MPCS ini (Gambar 1 ). Dalam STR, S. griseochromogenes mengonsumsi glukosa yang tersedia dalam waktu 24 jam. Titik masuk ke fase pertumbuhan stasioner ini sangat cocok dengan pertumbuhan dalam BSF, 24 DWP, dan 48 FP (Gambar 5A ). Konsentrasi biomassa akhir yang diperoleh dalam STR adalah 5,5 g/L dan sebanding dengan 4 g/L yang diperoleh dalam MPCS. Sebanyak 33 MF terdeteksi selama kultivasi dalam STR, yang merupakan jumlah MF tertinggi yang diamati dari semua sistem kultivasi yang diuji untuk S. griseochromogenes (Gambar 5B ). MF ini terdiri dari delapan MF yang unik untuk STR dan yang lainnya tumpang tindih sampai tingkat tertentu dengan MF yang telah ditemukan dalam sistem kultivasi lainnya. Mayoritas dari 19 MF dibagi di antara semua sistem kultivasi. Kesamaan tertinggi sebesar 89% ditemukan antara STR dan 48 FP. MF yang ditemukan dalam STR diklasifikasikan dalam hal kemunculannya yang bergantung pada waktu (Gambar S12 , S13 ) dan dibandingkan dengan profil produksi yang diamati dalam sistem kultivasi (Gambar 3 , S5 ). Secara keseluruhan, profil produksi SM yang diamati dalam STR cocok dengan profil yang diperoleh dalam MPCS daripada yang diperoleh dalam SF dan BSF. Jaringan molekuler S. griseochromogenes mengungkapkan keberadaan dua gugus molekuler 10 simpul, dua simpul ganda, dan tujuh simpul tunggal yang terkait dengan bahan kimia desferioksamin dan molekul leupeptin (Gambar 5C ). Semua SM yang diidentifikasi dalam kultivasi STR menunjukkan intensitas yang sebanding dengan yang diamati dalam sistem kultivasi, kecuali bahan kimia leupeptin dan desferioksamin E, yang menunjukkan intensitas tertinggi yang diamati dalam STR. Seperti yang diamati selama kultivasi dalam sistem kultivasi lainnya, bahan kimia leupeptin terdeteksi selama kultivasi dalam STR dengan profil produksi dari waktu ke waktu produksi & degradasi dan molekul desferioksamin dengan produksi awal atau produksi akhir. Selain itu, delapan simpul tunggal diidentifikasi yang hanya terdeteksi di STR dengan profil produksi produksi awal atau produksi akhir . Tiga dari simpul tunggal ini dapat dianotasi menjadi derivat desferioksamin NP-008730, yang memiliki gugus karboksil alih-alih gugus amina jika dibandingkan dengan desferioksamin B. Satu simpul dari delapan simpul tunggal, dianotasi sebagai aminobakteriohopanetriol dan termasuk dalam hopanoid, yang dihipotesiskan berperan dalam proses biologi sel dalam berbagai bakteri (Welander et al. 2012 ). Tingkat perbandingan tertinggi dari pertumbuhan dan produksi SM selama pembudidayaan S. griseochromogenes dalam STR diamati dengan 48 FP, yang dapat dikaitkan dengan kesamaan tertinggi dari ketersediaan oksigen, pencampuran, dan masukan daya jika dibandingkan dengan sistem pembudidayaan lainnya (Tabel 1 ) (Koepff et al. 2017 ). Namun, hasil menunjukkan bahwa selama kultivasi di STR, kombinasi stresor spesifik lainnya mungkin dihasilkan dibandingkan dengan sistem kultivasi lainnya, yang menghasilkan MF yang spesifik dan unik. Sebagai kesimpulan, penilaian kami mengungkapkan tingkat kesamaan yang tinggi dalam pertumbuhan dan jejak metabolik antara MPCS dan STR, sehingga meningkatkan kemungkinan menemukan kembali MF dari penyaringan awal di MPCS.
Studi ini menunjukkan bahwa ada pengaruh yang jelas dari sistem kultivasi pada pertumbuhan dan jejak metabolik B. amyloliquefaciens, C. coralloides, S. griseochromogenes dan S. Cattleya . Penggunaan MPCS meningkatkan penemuan NP bakteri tidak hanya karena kapasitasnya untuk memparalelkan kultivasi tetapi juga karena kinerjanya yang unggul dibandingkan dengan SF dan BSF. Hasilnya menunjukkan bahwa MPCS, khususnya 48 FP, memfasilitasi peningkatan pertumbuhan, produksi SM dan menghasilkan tingkat kesamaan yang lebih besar dengan STR dibandingkan dengan SF dan BSF. Secara umum, pertumbuhan, jumlah total SM dan profil produksinya dari waktu ke waktu dipengaruhi oleh sistem kultivasi yang berbeda. Hal ini dapat dikaitkan dengan tiga faktor: Pertama, parameter bioproses, termasuk material, OTR dan P/V, dari sistem kultivasi dapat sangat memengaruhi pertumbuhan dan produksi SM bakteri. Parameter bioproses ini dapat bertindak dalam kondisi suboptimal sebagai sumber stres, yang diperlukan untuk mengaktifkan gugus gen biosintetik diam dan memicu produksi SM (Pan et al. 2019 ; Romano et al. 2018 ). Misalnya, ini menunjukkan bahwa bakteri yang dibudidayakan mengalami tingkat stres yang lebih tinggi atau kombinasi stresor tertentu dalam 48 FP dibandingkan dengan sistem budidaya lainnya. Faktanya, bentuk bunga dari 48 FP bertindak sebagai penyekat, meningkatkan stres hidromekanis dan menghambat penggumpalan bakteri (Funke et al. 2009 ). Selain itu, penelitian sebelumnya telah menunjukkan bahwa penambahan partikel polistirena dan peningkatan konsentrasi oksigen selama budidaya dapat menyebabkan agregasi spesies oksigen reaktif intraseluler (Baez dan Shiloach 2014 ; Kim et al. 2022 ). Akibatnya, peningkatan tingkat stres atau kombinasi spesifik dari berbagai stresor menghasilkan profil SM yang lebih beragam selama budidaya dalam 48 FP. Kedua, kondisi suboptimal dan stres yang dialami selama kultivasi dapat berdampak besar pada pertumbuhan bakteri, yang mengakibatkan berbagai entri ke fase pertumbuhan stasioner atau bahkan ketidakhadirannya. Namun, hal ini memengaruhi produksi SM, karena sebagian besar SM bakteri diproduksi dengan dimulainya fase stasioner (Seyedsayamdost 2019 ). Peningkatan fase stasioner memungkinkan sel, dengan adanya stresor, untuk memodifikasi SM mereka atau seluruh mesin biosintesis agar sesuai dengan kebutuhan dan perubahan mereka selama kultivasi (Barona-Gómez et al. 2004 ; Kraboun et al. 2023 ; Pierwola et al. 2004 ; Senges et al. 2018 ; Seyedsayamdost 2019). Akibatnya, sistem kultivasi harus menyediakan keseimbangan optimal antara memungkinkan fase pertumbuhan cepat untuk memfasilitasi fase stasioner yang berkepanjangan dan tingkat stres yang memadai untuk merangsang produksi SM, dengan demikian meningkatkan keragaman SM yang diproduksi. Terakhir, perilaku morfologi bakteri yang dibudidayakan dalam sistem kultivasi berbeda hingga batas yang besar. Sementara tidak ada pengaruh yang diamati selama budidaya B. amyloliquefaciens dan C. coralloides , bakteri Streptomyces menunjukkan perilaku morfologi yang berbeda dalam sistem kultivasi. Budidaya bakteri dengan pertumbuhan kompleks, seperti Streptomyces , digambarkan sebagai tantangan karena sensitivitas konstruksi sel terhadap parameter budidaya, sementara bakteri tumbuh uniseluler tetap lebih mudah dibudidayakan dan kurang sensitif terhadap perubahan selama budidaya (Dusenbery 1998 ; Minas et al. 2000 ; Sohoni et al. 2012 ; Wang et al. 2017 ; Young 2007 ; Zacchetti et al. 2018 ). Selain itu, hubungan langsung antara morfologi pelet bakteri Streptomyces pada produksi NP dijelaskan dalam literatur (Minas et al. 2000 ; Sohoni et al. 2012 ; Wang et al. 2017 ; Zacchetti et al. 2018 ). Oleh karena itu, efek sistem kultivasi pada pertumbuhan dan produksi SM meningkat seiring dengan kompleksitas pertumbuhan sel dan morfologi bakteri yang diuji.
Bakteri menghasilkan campuran dan modifikasi SM yang berbeda sebagai respons terhadap sistem kultivasi. SM unik, yang hanya terdeteksi dalam satu sistem kultivasi, menunjukkan perubahan panjang rantai, substitusi asam amino, atau degradasi gugus kimia. Setiap perubahan dalam struktur molekuler dapat memengaruhi tujuan dan bioaktivitas SM secara signifikan. Misalnya, desferioksamin A1 aktif antibiotik hanya kehilangan satu gugus metil dan turunan desferioksamin aktif imunosupresif IC202D kehilangan satu asetamida dibandingkan dengan desferioksamin B yang tidak aktif (Chaimaa Katif et al. 2021 ; Iijima et al. 1999 ; Iijima et al. 2000 ). Secara umum, disarankan agar bakteri memodifikasi SM mereka untuk beradaptasi dengan kondisi lingkungan mereka saat ini (Spasojević et al. 1999 ). Oleh karena itu, bakteri mengalihkan mesin produksi mereka untuk membentuk turunan SM tambahan dengan aktivitas dan campuran yang berbeda untuk mengatasi masukan stres yang berasal dari sistem kultivasi.
Studi ini menunjukkan bahwa budidaya bakteri dalam MPCS menghasilkan campuran SM yang beragam, termasuk perwakilan kelas NP penting seperti peptida non-ribosomal, siderofor, dan N -asil-asam amino. Untuk lebih meningkatkan profil SM dan mengaktifkan BGC diam, masukan stres tambahan perlu diterapkan melalui metode seperti OSMAC (Bode et al. 2002 ; Pan et al. 2019 ; Romano et al. 2018 ). Penggunaan MPCS memungkinkan untuk menguji beberapa kondisi secara bersamaan, yang memungkinkan penerapan metode yang lebih kompleks seperti OSMAC bivariat dan skrining elisitor throughput tinggi (Lindig et al. 2023 ; Seyedsayamdost 2014 ). Ini secara signifikan meningkatkan jumlah SM yang diproduksi dan kemungkinan menemukan NP baru. Selain mengaktifkan BGC diam, pemurnian SM yang terbentuk sangat penting dalam penemuan NP. Dalam sebagian besar studi, sampel dipekatkan selama persiapan sampel menggunakan metode pemurnian seperti ekstraksi cair (Schwarz et al. 2021 ; Senges et al. 2018 ). Ini memastikan deteksi SM dengan konsentrasi rendah dan meningkatkan jumlah total. Oleh karena itu, perlu menggunakan proses pemurnian yang sederhana dan cepat untuk menangani peningkatan throughput sampel saat menggunakan MPCS. Penggunaan pelat pemurnian multi-sumur yang terintegrasi ke dalam proses pemurnian throughput tinggi otomatis dapat lebih mengurangi beban kerja dan meningkatkan jumlah SM (Badawy et al. 2022 ; Ginsburg-Moraff et al. 2022 ). Lebih jauh lagi, kami menunjukkan pertumbuhan dan produksi SM yang sebanding dalam STR dan MPCS. Ini akan memfasilitasi pengembangan proses fermentasi dan peningkatan skala untuk memasok jumlah yang lebih besar selama penemuan NP baru, terutama ketika MPCS yang dapat dipantau seperti 48 FP dengan kontrol pH dan DO diimplementasikan dalam lingkungan otomatis. Penerapan otomatisasi dalam pengujian elisitor selama pembudidayaan bakteri di MPCS telah dicapai melalui penggunaan metode penyaringan elisitor berthroughput tinggi (Seyedsayamdost 2019 ). Meskipun demikian, pengujian otomatis berbagai kondisi pembudidayaan di MPCS masih dalam tahap awal dan skalabilitas kondisi pembudidayaan tertentu yang berhasil belum sepenuhnya dieksplorasi. Oleh karena itu, penelitian dan pengembangan lebih lanjut diperlukan untuk menerapkan metode otomatisasi yang kuat untuk menguji berbagai kondisi pembudidayaan di MPCS, yang mungkin menjadi tantangan baru dalam penemuan NP di masa mendatang.


Leave a Reply